Les atomes et les molécules représentent deux premiers niveaux d'organisation de la matière. Mais ni molécules, ni les atomes, ne se rencontrent dans la nature isolément. La matière que nous pouvons voir ou toucher est un assemblage plus ou moins organisé d'atomes, de molécules ou d'ions. Des interactions de nature différente se manifestent entre les molécules ou entre les ions et permettent d'expliquer la dissolution des solides, la miscibilité des liquides et bien d'autres phénomènes.
I. Quelles sont les interactions dans la matière ?
Les interactions dans un solide ionique
• Un solide ionique cristallin est un solide constitué d'ions de charge positive, les cations, et d'ions de charge négative, les anions. Ces ions sont disposés de façon ordonnée dans le cristal. Le solide ionique est électriquement neutre.
• La formule d'un solide ou d'un cristal ionique, appelée formule statistique, indique la nature et la proportion des ions présents.
• On appelle interaction électrostatique, la force qui s'exerce entre deux entités chargées.
• Comme un cristal ionique est constitué d'ions, et comme chaque ion s'entoure d'ions de signes opposés, c'est l'interaction électrostatique qui assure la cohésion du cristal ionique.
Les interactions dans un solide moléculaire
• Un solide moléculaire est un cristal formé par une juxtaposition de molécules, selon un arrangement géométrique déterminé.
• On appelle interactions de Van Der Waals, trois formes distinctes d'interaction entre les molécules :
- Les interactions entre molécules polaires : le pôle positif de l'une attire le pôle négatif de l'autre.
• Exemple : la propanone de formule CH3 – CO – CH3 est une molécule polaire due à la présence de l'atome d'oxygène qui est plus électronégatif que le carbone et crée ainsi une liaison polarisée entre le carbone et l'oxygène. Ainsi le propane a une température de fusion (et d'ébullition) bien supérieure à ses homologues de même masse molaire, mais non polarisés. En effet, il faudra fournir plus d'énergie à un solide constitué de molécules polaires qu'à un solide constitué de molécules apolaires pour le faire passer de l'état solide à l'état liquide.
- Les interactions entre molécule polaire et molécule apolaire : le pôle négatif de la molécule polaire attire les noyaux (qui sont positifs) et repousse les électrons de la molécule apolaire.
- Les interactions entre molécules apolaires : c'est la force de cohésion entre atome ou molécules. En effet, dans la zone correspondant à la liaison covalente, les électrons sont en mouvement permanent. Si on observe leurs déplacements sur un intervalle de temps assez long, ces électrons sont aussi souvent près d'un noyau que de l'autre. Cependant, à un instant donné, il y a une forte chance pour que ces électrons ne soient pas équitablement répartis dans la zone qui correspond à la liaison, ce qui crée un dipôle électrostatique instantané. Une liaison covalente qui ne constitue pas un dipôle électrostatique permanent peut ainsi être polarisée de manière fugace. C'est le déplacement des électrons autour des noyaux qui crée un dipôle électrique instantané et assure la cohésion du cristal.
• La cohésion des cristaux moléculaires est assurée par les interactions de Van Der Waals. Comme ces interactions sont faibles, la température de fusion est généralement peu élevée. De plus, ces solides présentent une certaine fragilité, car le cristal ne nécessite pas la rupture de liaisons fortes. En effet, lorsque l'on casse un morceau de sucre, on ne fragmente pas la molécule.
Exercice n°1
Exercice n°1
La liaison par pont hydrogène
• Il existe des éléments très électronégatifs, comme l'azote N, l'oxygène O ou le fluor F. Lorsqu'un élément très électronégatif est lié à un atome d'hydrogène, une liaison fortement polarisée est créée, avec un moment dipolaire important.
• De plus, l'atome d'hydrogène H est très petit et les atomes N, O ou F sont également petits. Ces derniers vont pouvoir s'approcher des atomes d'hydrogène et apparaissent des interactions particulières appelées « liaisons par pont hydrogène » ou « liaisons hydrogène ».
• Exemple : dans le cas de l'eau et du chlorure d'hydrogène :
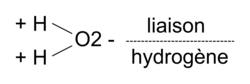 |
• Une liaison hydrogène se forme lorsqu'un atome d'hydrogène lié à un atome A , très électronégatif, interagit avec un atome B, très électronégatif aussi et porteur de doublets non liants.
• Les liaisons hydrogène s'établissent principalement entre les atomes F, O, N et Cl.
• Exemple : dans l'exemple précédent, l'atome A serait l'atome de chlore et l'atome B serait celui d'oxygène.
• La liaison hydrogène est notablement plus forte que les interactions de Van Der Waals. Elles sont responsables de l'élévation des températures de fusion et d'ébullition, ainsi que de la solubilité des solides dans les solvants.
Exercice n°2
Exercice n°2
II. La dissolution de solides ioniques dans l'eau
Que se passe-t-il lors de la dissolution d'un solide ionique dans l'eau ?
• Lorsque l'on dissout un soluté dans un solvant, le mélange obtenu est appelé solution. Si le solvant est l'eau, on parle alors de solution aqueuse. Une solution contenant des ions est appelée électrolyte et laisse passer le courant. Toute solution est électriquement neutre.
• L'eau est un solvant polaire : le barycentre des charges négatives n'est pas confondu avec celui des charges positives. Un cristal ionique est plongé dans l'eau. Les molécules d'eau à la surface du cristal affaiblissent les liaisons électrostatiques entre les ions. Des ions se détachent de l'édifice sous l'effet de l'agitation thermique : on dit que le cristal se dissocie ou se disloque.
• Un ion libéré établit des liaisons de type électrostatique avec les molécules d'eau : on dit que l'ion se solvate ou s'hydrate. Pour indiquer que les ions sont hydratés, on ajoute l'indication « (aq) » à la suite de leurs symboles.
• Les ions hydratés se dispersent dans la solution sous l'effet de l'agitation thermique. Les solides ioniques sont très solubles dans les solvants polaires.
• Remarque : si le solvant n'est pas de l'eau, il faudra utiliser le terme solvatation à la place d'hydratation.
• Un ion est donc entouré de plusieurs molécules d'eau. Le nombre de ces molécules dépend de la charge de l'ion et de sa taille. Le plus petit ion, le proton H+, peut s'associer par une véritable liaison chimique à une molécule d'eau pour former l'ion oxonium (on l'appelle aussi ion hydronium par abus de langage) H3O+.
Équation d'une réaction de dissolution dans l'eau
• L'équation de dissolution d'une solution ionique doit respecter la conservation des éléments et de la charge.
• Ainsi lorsque l'on dissout du sel de table dans l'eau, le soluté est le chlorure de sodium. Le solvant est l'eau. Les cristaux se dissocient et les ions s'hydratent. Après un certain temps, le solide ionique chlorure de sodium a disparu de la solution :
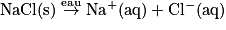
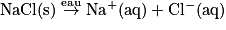
• Si on appelle c (NaCl) la concentration en chlorure de sodium initiale, la concentration des ions dans la solution obtenue est ici : [Na+(aq)] = [Cl−(aq)] = [c (NaCl)
• Exemple : 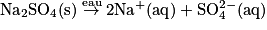 .
.
Avec, c(Na2SO4) la concentration en soluté apporté, on aura :
![[\textrm{SO}_{4}^{2-}(\textrm{aq})]= \textit{c}(\textrm{Na}_{2}\textrm{SO}_{4})](https://static1.assistancescolaire.com/1/images/1_ph_05_m3.png) et [Na+(aq)] = 2 × c(Na2SO4).
et [Na+(aq)] = 2 × c(Na2SO4).
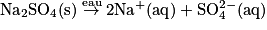 .
.Avec, c(Na2SO4) la concentration en soluté apporté, on aura :
![[\textrm{SO}_{4}^{2-}(\textrm{aq})]= \textit{c}(\textrm{Na}_{2}\textrm{SO}_{4})](https://static1.assistancescolaire.com/1/images/1_ph_05_m3.png) et [Na+(aq)] = 2 × c(Na2SO4).
et [Na+(aq)] = 2 × c(Na2SO4).• La concentration de l'ion est la concentration du soluté multipliée par le nombre stœchiométrique qui se trouve devant cet ion.
• En généralisant, on peut aboutir aux équations suivantes :
III La solubilité d'un soluté dans un solvant
Dissolution d'un soluté polaire dans un solvant polaire
• Si les molécules du corps sont polaires, elles interagissent avec les molécules d'eau et des liaisons intermoléculaires s'établissent. Le corps est donc soluble dans l'eau. Ces liaisons intermoléculaires sont les liaisons hydrogène.
• Les liaisons hydrogène affaiblissent les liaisons intramoléculaires polaires des molécules d'eau et du corps.
• Si les molécules du corps ne sont pas polaires. Le corps n'est pas (ou peu) soluble dans l'eau.
• Les solutés polaires sont solubles dans les solvants polaires.
Dissolution d'un soluté apolaire dans un solvant apolaire
Les solutés moléculaires apolaires ou peu polaires sont généralement solubles dans les solvants apolaires.Qu'est-ce que la solubilité ?
• La solubilité représente la capacité d'une espèce chimique à se dissoudre dans un solvant. Plus l'espèce se dissout, plus la solubilité est grande. Elle correspond à la masse maximale de soluté que l'on peut dissoudre par litre de solvant à une température donnée. Son unité est le gramme par litre : 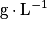 .
.
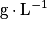 .
.• Exemple : la solubilité du sel dans l'eau est 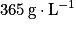 à 25 °C.
à 25 °C.
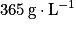 à 25 °C.
à 25 °C.• Lorsque l'on ne peut plus dissoudre de soluté dans un solvant, on dit que la solution est saturée.
Extraction par solvant
• Une extraction consiste à retirer une ou plusieurs espèces chimiques d'un mélange solide ou liquide.
• L'extraction par solvant consiste à faire passer une espèce d'un solvant à un autre. L'espèce à extraire est plus soluble dans le solvant d'extraction que dans le solvant de départ. Le solvant d'extraction est choisi de telle sorte que les deux solvants ne soient pas miscibles. (On dit que deux liquides sont miscibles lorsqu'ils forment un mélange homogène.)
• Pour cela, on utilise une ampoule à décanter : elle permet de séparer deux liquides qui ne sont pas miscibles. La phase la plus dense se retrouve en bas de l'ampoule : en général, ce sera la phase aqueuse. La phase la moins dense se retrouve au-dessus : en général, ce sera la phase organique.
Exercice n°4
Exercice n°4
IV Les tensioactifs
• Un tensioactif est une molécule qui se compose d'un côté hydrophile (qui a des affinités avec l'eau) et d'un côté lipophile (qui a des affinités pour les lipides). On dit que ce sont des molécules amphiphiles.
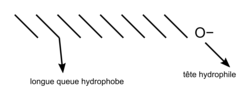 |
• Ils peuvent être utilisés comme détergent. Les plus connus sont les savons : ce sont des carboxylates de sodium ou de potassium.
• Lorsque l'on met les composés tensioactifs dans l'eau, on obtient un film à la surface de l'eau. S'il y a suffisamment de composés tensioactifs dans l'eau, ils se réunissent en agrégats appelés micelles : ce sont des boules où toutes les têtes hydrophiles se tournent vers l'eau.
• Lorsque l'on frotte le savon sur la tache grasse d'un tissu, les tensioactifs l'entourent.
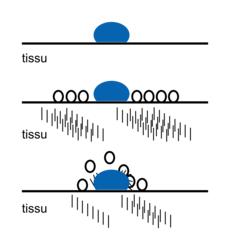 |
• Ils décollent la tâche du tissu et forment ensuite une micelle. Celle-ci sera éliminée avec les eaux de rinçage.
• Ils peuvent être utilisés comme agent émulsifiant, car ils facilitent le mélange entre deux liquides non miscibles. Ils permettent ainsi d'obtenir des émulsions stables. Une émulsion stable est un ensemble hétérogène composé de micelles enfermant en leur sein des particules de corps gras ; les micelles restent au milieu de l'eau.
• En cosmétologie, toutes les crèmes contiennent des tensioactifs. De même lorsque l'on met du jaune d'œuf pour faire « prendre » une mayonnaise, on ajoute des molécules de tensioactifs, comme la lécithine, qui permet l'émulsion de l'huile et du vinaigre.
À savoir et savoir réaliser :
- Expliquer la cohésion au sein de composés solides ioniques et moléculaires, par l'analyse des interactions entre entités.
- Savoir que la cohésion dans un solide peut être modélisée par des interactions entre ions, entre entités polaires, entre entités apolaires.
- Connaître la modélisation par pont hydrogène.
- Expliquer la capacité de l'eau à dissocier une espèce ionique et à solvater les ions.
- Modéliser, au niveau macroscopique, la dissolution d'un composé ionique dans l'eau par une équation de réaction, en utilisant les notations (s) et (aq).
- Calculer la concentration des ions dans la solution obtenue.
- Expliquer ou prévoir la solubilité d'une espèce chimique dans un solvant par l'analyse des interactions entre les entités.
- Connaître la notion de solubilité dans un solvant et de miscibilité de deux liquides.
- Interpréter un protocole d'extraction liquide-liquide à partir des valeurs de solubilité de l'espèce chimique dans les deux solvants.
- Choisir un solvant et mettre en œuvre un protocole d'extraction liquide-liquide d'un soluté moléculaire.
- Connaître les notions d'hydrophilie, lipophilie et amphiphilie d'une espèce chimique organique.
- Expliquer le caractère amphiphile et les propriétés lavantes d'un savon à partir de la formule semi-développée de ses entités. Citer des applications usuelles de tensioactifs.
- Illustrer les propriétés des savons.
Exercice n°1
La cohésion dans les solides ioniques est, principalement, due :
Cochez la bonne réponse.
| ||
| ||
|
La cohésion des solides est due à différentes interactions. Mais l'interaction principale dans les solides ioniques est une interaction de type électrostatique. Dans les solides moléculaires, ce sont les interactions de Van Der Waals qui assurent la cohésion. Ces dernières peuvent être de différentes formes. On trouve les interactions entre molécules polaires, entre molécule polaire et molécule apolaire ou entre molécules apolaires. Dans les interactions entre molécules apolaires, ce sont les dipôles électriques instantanés créés par le déplacement des électrons qui assurent la cohésion.
Exercice n°2
Dans quels cas peut-on avoir des liaisons par pont hydrogène ?
 |
Cochez la (ou les) bonne(s) réponse(s).
| ||
| ||
| ||
|
Données : électronégativités des atomes
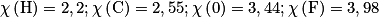
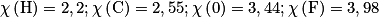
Cochez la (ou les) bonne(s) réponse(s).
| ||
| ||
| ||
|
Dans le cas A, l'atome d'oxygène est plus électronégatif que l'hydrogène. Il crée une charge partielle positive sur l'hydrogène. L'autre atome d'oxygène possède des doublets non liants. Il se forme des liaisons par pont hydrogène.
Dans le cas B, l'atome de fluor est plus électronégatif que l'hydrogène. Il crée une charge partielle positive sur l'hydrogène. L'autre atome de fluor possède des doublets non liants. Il se forme des liaisons par pont hydrogène.
Dans le cas D, il y a deux possibilités de liaisons par pont hydrogène : entre un atome d'oxygène et un atome d'hydrogène portés par deux molécules différentes.
Dans le cas C, il n'y a que des interactions de types électrostatiques qui peuvent exister.
Dans le cas B, l'atome de fluor est plus électronégatif que l'hydrogène. Il crée une charge partielle positive sur l'hydrogène. L'autre atome de fluor possède des doublets non liants. Il se forme des liaisons par pont hydrogène.
Dans le cas D, il y a deux possibilités de liaisons par pont hydrogène : entre un atome d'oxygène et un atome d'hydrogène portés par deux molécules différentes.
Dans le cas C, il n'y a que des interactions de types électrostatiques qui peuvent exister.
Exercice n°3
On dissout le sulfate de fer III, Fe2(SO4)3 dans de l'eau. La concentration en sulfate de fer III est notée c. Que vaut la concentration en ions obtenue ?
Cochez la (ou les) bonne(s) réponse(s).
| ||
| ||
| ||
| ||
| ||
| ||
| ||
|
L'équation de dissolution du solide ionique est : 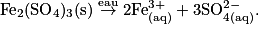
Avec la stœchiométrie de la réaction, on aboutit à la relation suivante :![\frac{c(\textrm{Fe}_{2}(\textrm{SO}_{4})_{\textrm{3}}(\textrm{s}))}{1}= \frac{[\textrm{Fe}_{(\textrm{aq})}^{3+}]}{2}= \frac{[\textrm{SO}_{4(\textrm{aq})}^{2-}]}{3}.](https://static1.assistancescolaire.com/1/images/1_ph_05_m17.png)
D'où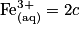 et
et ![[\textrm{SO}_{4(\textrm{aq})}^{2-}]= 3c](https://static1.assistancescolaire.com/1/images/1_ph_05_m19.png) .
.
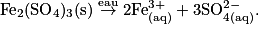
Avec la stœchiométrie de la réaction, on aboutit à la relation suivante :
![\frac{c(\textrm{Fe}_{2}(\textrm{SO}_{4})_{\textrm{3}}(\textrm{s}))}{1}= \frac{[\textrm{Fe}_{(\textrm{aq})}^{3+}]}{2}= \frac{[\textrm{SO}_{4(\textrm{aq})}^{2-}]}{3}.](https://static1.assistancescolaire.com/1/images/1_ph_05_m17.png)
D'où
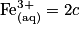 et
et ![[\textrm{SO}_{4(\textrm{aq})}^{2-}]= 3c](https://static1.assistancescolaire.com/1/images/1_ph_05_m19.png) .
.Exercice n°4
Choisis la(ou les) bonne(s) réponse(s) :
Cochez la (ou les) bonne(s) réponse(s).
| ||
| ||
| ||
| ||
|
L'extraction par solvant permet de faire migrer une espèce à extraire dans un autre solvant. Pour ce faire, on choisit un solvant qui n'est pas miscible au solvant de départ et dans lequel l'espèce est plus soluble. On obtient ainsi deux phases distinctes que l'on peut séparer avec une ampoule à décanter.
![\frac{\textit{c}\left ( \textrm{A}(s) \right )}{\textrm{a}}= \frac{[\textrm{B}\left ( \textrm{aq} \right )]}{\textrm{b}}= \frac{[\textrm{D}\left ( \textrm{aq} \right )]}{\textrm{d}}.](https://static1.assistancescolaire.com/1/images/1_ph_05_m4.png)
![[\textrm{Fe}_{\left ( \textrm{aq} \right )}^{3+}]= 2\textit{c}](https://static1.assistancescolaire.com/1/images/1_ph_05_m8.png)
![[\textrm{Fe}_{\left ( \textrm{aq} \right )}^{3+}]= \frac{c}{3}](https://static1.assistancescolaire.com/1/images/1_ph_05_m9.png)
![[\textrm{Fe}_{(\textrm{aq})}^{3+}]= \frac{c}{2}](https://static1.assistancescolaire.com/1/images/1_ph_05_m10.png)
![[\textrm{Fe}_{\left ( aq \right )}^{3+}]= 3c](https://static1.assistancescolaire.com/1/images/1_ph_05_m11.png)
![[\textrm{SO}_{4(\textrm{aq})}^{2-}]= 2c](https://static1.assistancescolaire.com/1/images/1_ph_05_m12.png)
![[\textrm{SO}_{4(\textrm{aq})}^{2-}]= \frac{c}{3}](https://static1.assistancescolaire.com/1/images/1_ph_05_m13.png)
![[\textrm{SO}_{4(\textrm{aq})}^{2-}]= \frac{c}{2}](https://static1.assistancescolaire.com/1/images/1_ph_05_m14.png)
![[\textrm{SO}_{4(\textrm{aq})}^{2-}]=3c](https://static1.assistancescolaire.com/1/images/1_ph_05_m15.png)

