La représentation des molécules et des ions est utilisée pour décrire la nature et ainsi déterminer les structures d'autres espèces chimiques. Elle permet de comprendre les interactions entre molécules et ions. La géométrie des molécules et de la polarité influence un certain nombre de caractéristiques physiques (point de fusion, point d'ébullition, solubilité) ou chimiques (réactivité).
I. Formation des molécules
• L'atome est constitué d'un noyau et d'électrons qui se déplacent autour. Le nombre de protons du noyau s'appelle nombre de charge ou numéro atomique et se note Z. Comme l'atome est électriquement neutre, le nombre de protons est égal au nombre d'électrons. La configuration électronique d'un atome est donnée par la répartition de ses électrons. On appelle électrons de valence les électrons situés sur la dernière couche remplie.
• Chaque couche est numérotée. La couche n = 1 correspond à la couche K, la couche n = 2 correspond à la couche L et la couche n = 3 correspond à la couche M.
• Une couche électronique ne peut contenir qu'un nombre limité d'électrons : 2 électrons sur les sous-couches 1s, 2s et 3s ; 6 électrons sur les sous-couches 2p et 3p.
• Une couche contenant un nombre maximal d'électrons est dite saturée. Les électrons commencent par occuper la sous-couche 1s, puis la 2s et ainsi de suite. Ils ne peuvent se placer sur une nouvelle sous-couche si la précédente n'est pas pleine.
• Les électrons de valence sont appelés électrons célibataires s'ils sont seuls et doublet non liant s'ils sont appareillés par deux.
Stabilité chimique et liaison covalente
• Les atomes dont la couche externe est déjà saturée n'ont pas tendance à établir de liaison avec d'autres atomes. Ils sont dits « chimiquement stables ». Ce sont les gaz nobles (dernière colonne du tableau périodique).
• Lorsque les atomes sont « instables » chimiquement, ils subissent des transformations, en ions, ou en établissant des liaisons avec d'autres atomes. Ils réalisent une liaison covalente (liaison chimique), en mettant en commun chacun un électron de sa couche externe. Ces deux électrons forment un doublet liant.
• En réalisant une liaison covalente, chaque atome peut alors saturer sa couche externe, et devenir stable.
Les règles du duet et de l'octet
• Règle du duet : au cours de leurs transformations chimiques, les atomes caractérisés par Z 4 évoluent de manière à saturer leur couche n = 1 ou K. Ils acquièrent un « duet » d'électrons, c'est-à-dire 1 doublet d'électrons.
• Règle de l'octet : au cours de leurs transformations chimiques, les atomes caractérisés par Z 5 évoluent de manière à saturer leur couche externe n = 2 (L) ou n = 3 (M), etc. Ils acquièrent un « octet » d'électrons, c'est-à-dire 8 électrons ou 4 doublets d'électrons.
• Exemple : Le numéro atomique de l'atome de chlore (Cl) est Z = 17.
Sa structure électronique est : (1s)² (2s)² (2p)6 (3s)² (3p)5. Il possède 7 électrons sur sa couche externe, ici M.
Pour devenir stable, il va mettre en commun un électron avec un autre atome instable.
Le numéro atomique de l'atome d'hydrogène H est Z = 1.
Sa structure électronique est (1s)1. Il possède un électron célibataire.
Pour devenir stable, il va mettre en commun son électron célibataire avec un autre atome.
Ainsi ces deux atomes réalisent une liaison covalente : H − Cl.
Sa structure électronique est : (1s)² (2s)² (2p)6 (3s)² (3p)5. Il possède 7 électrons sur sa couche externe, ici M.
Pour devenir stable, il va mettre en commun un électron avec un autre atome instable.
Le numéro atomique de l'atome d'hydrogène H est Z = 1.
Sa structure électronique est (1s)1. Il possède un électron célibataire.
Pour devenir stable, il va mettre en commun son électron célibataire avec un autre atome.
Ainsi ces deux atomes réalisent une liaison covalente : H − Cl.
• Remarque : ces deux règles de stabilité chimique s'appliquent aux 18 premiers éléments de la classification périodique (3 premières périodes ou lignes).
• Il est alors possible de prévoir le nombre de liaisons (doublets liants) que peut faire un atome.
| Atome | Numéro atomique Z | Structure électronique | Électrons manquants pour être stable | Doublets liants |
|---|---|---|---|---|
| Hydrogène (H) | 1 | (1s)1 | 2 − 1 = 1 | 1 |
| Carbone (C) | 6 | (1s)2 (2s)² (2p)2 | 8 − 4 = 4 | 4 |
| Azote (N) | 7 | (1s)2 (2s)2 (2p)3 | 8 − 5 = 3 | 3 |
| Oxygène (O) | 8 | (1s)2 (2s)2 (2p)4 | 8 − 6 = 2 | 2 |
Le schéma de Lewis des molécules
• Les doublets liants sont les doublets mis en commun entre deux atomes. Ce sont eux qui assurent les liaisons entre les atomes.
• Les doublets non liants sont les paires d'électrons qui ne servent pas de liaisons entre deux atomes.
• La représentation de Lewis d'une molécule fait apparaître tous les atomes de la molécule ainsi que tous les doublets liants et non liants le cas échéant.
• Dans la représentation de Lewis, les règles du « duet » et de « l'octet » doivent être satisfaites.
• Méthode permettant d'établir la représentation de Lewis d'une molécule :
- chercher le numéro atomique de chaque atome de la molécule ;
- donner la structure électronique de chaque atome ;
- déterminer le nombre d'électrons externes de chaque atome de la molécule (ne) ;
- en déduire le nombre de liaisons nl qu'il peut engager (nl = 8 − ne) ;
- vérifier la validité de la règle de l'octet (ou du duet) en complétant avec les doublets non liants ;
- dessiner la molécule en représentant les atomes et tous ses doublets.
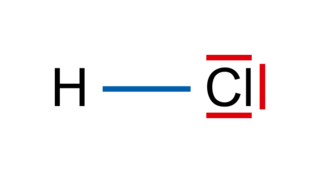
• Exemple : on veut représenter le modèle de Lewis de la molécule de chlorure d'hydrogène HCl, avec la méthode précédente :
- 1re étape : H : Z = 1 ; Cl : Z = 17 ;
- 2e étape : H : (1s)1 ; Cl : (1s)2 (2s)2 (2p)6 (3s)2 (3p)5 ;
- 3e étape : H : 1 électron externe. Cl : 7 électrons externes ;
- 4e étape : H établit 2 − 1 = 1 doublet liant et Cl établit nécessairement 8 − 7 = 1 doublet liant ;
- 5e étape : Il reste donc 3 doublets non liants à répartir autour de l'atome de chlore de façon à respecter la règle de l'octet. Le respect de la règle du duet est assuré pour l'atome d'hydrogène par la présence du doublet liant.
- 6e étape : La représentation de Lewis de la molécule est :
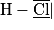 .
.
 |
II. Quelle géométrie pour les molécules ?
• La disposition spatiale des doublets d'électrons permet d'expliquer la forme, donc la géométrie de la molécule.
• Théorie de Gillespie : la répulsion minimale des doublets permet de rendre compte de la géométrie des molécules : les doublets d'électrons se placent les plus éloignés les uns des autres de façon à minimiser leur répulsion.
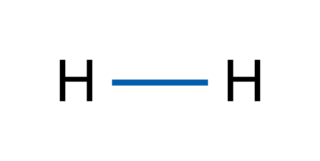
• Les molécules formées de deux atomes sont linéaires.
 |
III. Formation des ions
Rappels sur les ions
• Au cours des réactions chimiques, certains atomes vont perdre ou gagner des électrons pour répondre aux règles de stabilité électronique. Ils se transforment en cations s'ils perdent des électrons, et en anions lorsqu'ils en gagnent.
• Exemples :
- Le numéro atomique de l'atome de chlore est Z = 17. (1s)2 (2s)2 (2p)6 (3s)2 (3p)5. Pour obtenir une structure électronique stable (règle de l'octet) il va gagner un électron et se transformer en l'anion chlorure de formule Cl-. L'anion Cl- possède 18 électrons.
- La structure électronique de Cl- est (1s)2 (2s)2 (2p)6 (3s)2 (3p)6.
- Le numéro atomique de l'atome de lithium Li est Z = 3. Sa structure électronique est (1s)² (2s)1. Pour obtenir une structure électronique stable (règle du duet), il va perdre un électron et se transformer en cation lithium de formule Li+. Le cation Li+ possède 2 électrons.
- La structure électronique de Li+ est (1s)2.
• Un ion polyatomique est constitué de plusieurs atomes, le tout ayant gagné ou perdu un ou plusieurs électrons.
Le schéma de Lewis des ions
• Comme pour les molécules, il est possible de déterminer les schémas de Lewis des ions courants. Ainsi en utilisant la méthode pour les molécules, on obtiendra les résultats suivants pour les ions monoatomiques :
| Nom de l'ion | Numéro atomique de l'atome. | Nombre d'électrons de l'ion | Structure électronique | Nombre d'électrons sur la couche externe | Représentation de Lewis | Doublets | |
|---|---|---|---|---|---|---|---|
| Ion hydrogène H+ | Z = 1 | 1 − 1 = 0 | (1s)0 | 0 |
| Aucun doublet | |
| Ion sodium Na+ | Z = 11 | 11 − 1 = 10 | (1s)2 (2s)2 (2p)6 | 8 | 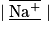 | 4 doublets non liants | |
| Ion chlorure Cl− | Z = 17 | 17 + 1 = 18 | (1s)2 (2s)2 (2p)6 (3s)2 (3p)6 | 8 | 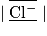 | 4 doublets non liants | |
| Ion oxyde O2- | Z = 8 | 8 + 2 = 10 | (1s)2 (2s)2 (2p)6 | 8 | 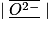 | 4 doublets non liants |
• On remarque que l'ion hydrogène n'a plus d'électron. Il présente un déficit d'électrons par rapport à la règle du duet (ou de l'octet dans le cas d'un autre type d'ion). On représente ce déficit par une lacune électronique symbolisée par un rectangle vide.
• En utilisant la méthode pour les molécules, on obtiendra les résultats suivants pour les ions polyatomiques :
Exercice n°4
| Ion polyatomique | Représentation de Lewis | Doublets de l'atome central | Géométrie de l'ion | |
|---|---|---|---|---|
| Ion hydronium H3O+ | 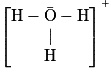 | 3 liaisons simples 1 doublet non liant | Structure pyramidale
| |
| Ion ammonium NH4+ | 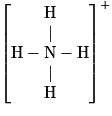 | 4 liaisons simples | Structure tétraédrique
| |
| Ion hydroxyde OH- | ![\left [| \mathrm{\overline{\underline{O}}} -\mathrm{H}\right ]^{-}](https://static1.assistancescolaire.com/1/images/1_ph_04_m7.png) | 1 liaison simple doublets non liants autour de l'atome d'oxygène | Structure linéaire 1
|
IV. Comment détermine-t-on si une molécule est polaire ou apolaire ?
À quoi sert l'électronégativité des atomes ?
• L'électronégativité d'un élément est la tendance d'un élément à attirer le doublet d'une liaison covalente dans laquelle il est engagé.
• Ainsi, l'électronégativité des éléments augmente lorsque l'on se déplace de gauche à droite dans une période (ligne) du tableau périodique des éléments.
• Et l'électronégativité des éléments augmente lorsqu'on se déplace de bas en haut dans une famille (colonne) du tableau périodique des éléments.
Qu'est-ce qu'une liaison polarisée ?
• Une molécule est un assemblage d'atomes liés entre eux par des liaisons de covalence. X et Y sont deux atomes liés dans la molécule. Si X et Y ont des électronégativités différentes, l'élément le plus électronégatif attire à lui les électrons de la liaison covalente. Cette liaison est polarisée et constitue un dipôle électrostatique.
• Exemple : la molécule de chlorure d'hydrogène HCl est constituée d'un atome d'hydrogène lié à un atome de chlore par une liaison covalente. Or, l'atome de chlore est beaucoup plus électronégatif que l'hydrogène. Il attire vers lui le doublet de la liaison : on dit que la liaison H − Cl est polarisée.
• Cette polarisation fait apparaître :
- un excédent de charge négative sur l'atome de chlore (représente une charge partielle) ;
- un excédent de charge positive sur l'atome d'hydrogène.
• La molécule de chlorure d'hydrogène a un caractère dipolaire : elle constitue un dipôle électrique.
• Un dipôle électrique est l'ensemble constitué par 2 charges électriques opposées et séparées par la distance d.
• Ce moment dipolaire est représenté par un vecteur 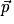 colinéaire à la liaison et orienté du pôle – vers le pôle + du dipôle. Le moment dipolaire s'exprime en Debye (symbole D).
colinéaire à la liaison et orienté du pôle – vers le pôle + du dipôle. Le moment dipolaire s'exprime en Debye (symbole D).
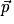 colinéaire à la liaison et orienté du pôle – vers le pôle + du dipôle. Le moment dipolaire s'exprime en Debye (symbole D).
colinéaire à la liaison et orienté du pôle – vers le pôle + du dipôle. Le moment dipolaire s'exprime en Debye (symbole D).• Pour la molécule de chlorure d'hydrogène : p (H − Cl) = 1,1 D.
• Définition : Une liaison covalente est polarisée lorsque les deux atomes liés ont des électronégativités différentes.Exercice n°4
Comment détermine-t-on la polarité des molécules ?
Une molécule, entre eux atomes A et B, est polarisée si ces deux atomes ont des électronégativités différentes. Plus la différence d'électronégativité est importante, plus la liaison est polarisée, et plus le moment dipolaire 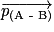 est grand. Une molécule diatomique constituée de deux atomes identiques est apolaire. Une molécule diatomique constituée de deux atomes différents est généralement polaire.
est grand. Une molécule diatomique constituée de deux atomes identiques est apolaire. Une molécule diatomique constituée de deux atomes différents est généralement polaire.
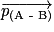 est grand. Une molécule diatomique constituée de deux atomes identiques est apolaire. Une molécule diatomique constituée de deux atomes différents est généralement polaire.
est grand. Une molécule diatomique constituée de deux atomes identiques est apolaire. Une molécule diatomique constituée de deux atomes différents est généralement polaire.Cas de la molécule d'eau H2O
• L'oxygène est plus électronégatif que l'hydrogène. Les deux liaisons covalentes O − H d'une molécule d'eau sont polarisées. Le moment dipolaire de la liaison O − H est tel que p (H− O) = 1,5 D. Les électrons symbolisés par les flèches rouges sont attirés vers l'atome le plus électronégatif, ici l'atome d'oxygène.
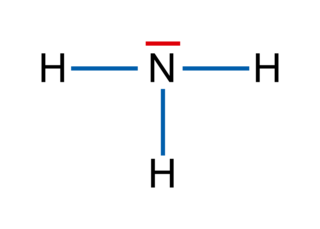 |
• Le moment dipolaire résultant est égal à la somme vectorielle des moments dipolaires des deux liaisons O − H.
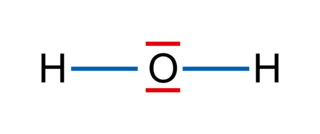 |
• Comme la molécule d'eau est coudée, le moment dipolaire résultant n'est pas nul : le barycentre (le milieu) des charges positives n'est pas confondu avec le barycentre des charges négatives.
• Remarque : la molécule d'eau a un moment dipolaire p (H2O)  1,8 D.
1,8 D.
 1,8 D.
1,8 D.• La molécule présente un caractère dipolaire : c'est une molécule polaire.
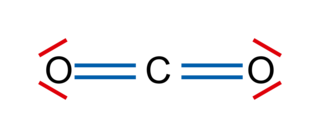
Cas de la molécule de dioxyde de carbone CO2
• L'oxygène est plus électronégatif que le carbone. Les deux liaisons covalentes O = C d'une molécule de dioxyde de carbone sont polarisées.
• Il en résulte l'apparition de charges partielles sur chaque atome d'oxygène et d'une charge partielle 2 sur l'atome de carbone.
• Comme la molécule de dioxyde de carbone est linéaire, le moment dipolaire résultant est nul : le barycentre (le milieu) des charges positives est confondu avec le barycentre des charges négatives.
• La molécule de dioxyde de carbone est une molécule apolaire.
Exercice n°5
Exercice n°5
À savoir et savoir réaliser :
- Établir le schéma de Lewis de molécules et d'ions mono ou polyatomiques, à partir du tableau périodique.
- Connaître l'existence de lacune électronique.
- Savoir déterminer la géométrie des entités.
- Interpréter la géométrie d'une entité à partir de son schéma de Lewis.
- Savoir comment évolue l'électronégativité dans le tableau périodique.
- Déterminer le caractère polaire d'une liaison à partir de la donnée de l'électronégativité des atomes.
- Déterminer le caractère polaire ou apolaire d'une entité moléculaire à partir de sa géométrie et de la polarité de ses liaisons.
Exercice n°1
Le numéro atomique de l'atome d'azote est Z = 7. Combien d'électrons de valence possède-t-il ?
Cochez la bonne réponse.
| ||
| ||
|
La structure électronique de l'atome d'azote est : (1s)2 (2s)2 (2p)3. Sur la couche n = 2 (couche L), il possède 5 électrons de valence. Il lui manque donc d'après la règle de l'octet : 8 − 5 = 3 électrons pour être stable. Il va donc former trois liaisons covalentes (doublets liants). Les électrons se trouvant sur la sous-couche 2s vont former un doublet non liant.
Exercice n°2
Le sulfure d'hydrogène est une molécule de formule H2S. Le numéro atomique du soufre S est Z = 16 et celui de l'hydrogène est Z = 1.
Quelle est la représentation de Lewis correcte ?
Quelle est la représentation de Lewis correcte ?
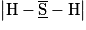 | 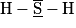 | 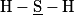 | 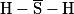 |
| Molécule A | Molécule B | Molécule C | Molécule D |
Cochez la bonne réponse.
| ||
| ||
| ||
|
Les structures électroniques de l'atome d'hydrogène et de l'atome de soufre sont :
H : (1s)1 ; S : (1s)2 (2s)2 (2p)6 (3s)2 (3p)4.
Il manque à l'atome de soufre, d'après la règle de l'octet : 8 − 6 = 2 électrons pour être stable. Il va donc former deux liaisons covalentes (doublets liants). Les électrons se trouvant sur la sous-couche 3s et ceux qui sont déjà appareillés sur la sous-couche 3p vont former deux doublets non liants.
H : (1s)1 ; S : (1s)2 (2s)2 (2p)6 (3s)2 (3p)4.
Il manque à l'atome de soufre, d'après la règle de l'octet : 8 − 6 = 2 électrons pour être stable. Il va donc former deux liaisons covalentes (doublets liants). Les électrons se trouvant sur la sous-couche 3s et ceux qui sont déjà appareillés sur la sous-couche 3p vont former deux doublets non liants.
Exercice n°3
Quelle est la géométrie de la molécule de chloramine dont la formule de Lewis est donnée :
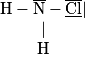
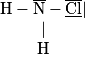
Cochez la bonne réponse.
| ||
| ||
| ||
| ||
|
Pour satisfaire la théorie de Gillespie, les doublets d'électrons se placent le plus éloigné possible les uns des autres. Ainsi l'atome d'azote N va occuper la place centrale d'un tétraèdre : les deux atomes d'hydrogène occupent un des sommets et l'atome de chlore occupe un troisième sommet. La molécule est pyramidale puisque le quatrième sommet du tétraèdre n'est pas occupé par un atome.
Exercice n°4
L'ion oxyde O2− provient de l'atome d'oxygène de numéro atomique Z = 8. Parmi les affirmations suivantes, lesquelles sont correctes ?
Cochez la (ou les) bonne(s) réponse(s).
| ||
| ||
| ||
| ||
|
Comme l'ion est chargé négativement, il a gagné 2 électrons : il possédera 10 électrons en tout.Sa structure électronique est (1s)2 (2s)2 (2p)6. Il possède donc 8 électrons de valence (il satisfait à la règle de l'octet). Ces 8 électrons de valence vont former 4 doublets non liants.
Exercice n°5
La représentation de Lewis de la molécule de chloroamine est donnée ci-dessous :
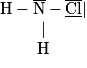
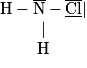
Cochez la (ou les) bonne(s) réponse(s).
| ||
| ||
| ||
| ||
| ||
|
La différence d'électronégativité entre les atomes d'azote et de chlore est nulle. La liaison entre ces deux atomes est donc une liaison non polarisée.
En revanche, la différence d'électronégativité entre les atomes d'azote et d'hydrogène est non nulle. L'azote attire vers lui les électrons des deux doublets liants. Apparaît une charge partielle négative sur l'atome d'azote et une charge partielle positive sur chaque atome d'hydrogène. Comme le barycentre des charges positives n'est pas confondu avec le barycentre des charges négatives, car la molécule est pyramidale, alors la molécule est polaire.
En revanche, la différence d'électronégativité entre les atomes d'azote et d'hydrogène est non nulle. L'azote attire vers lui les électrons des deux doublets liants. Apparaît une charge partielle négative sur l'atome d'azote et une charge partielle positive sur chaque atome d'hydrogène. Comme le barycentre des charges positives n'est pas confondu avec le barycentre des charges négatives, car la molécule est pyramidale, alors la molécule est polaire.