Une formule chimique évoque des propriétés physiques et chimiques, elle est un outil qui permet de rationaliser et de prévoir le comportement des espèces chimiques et ainsi leur réactivité. Une molécule organique comporte un squelette hydrocarboné et éventuellement des groupes caractéristiques (appelés groupes fonctionnels).
I. Qu'est-ce qu'un alcane ?
Un alcane est un hydrocarbure dont la molécule ne comporte que des liaisons covalentes simples. On dit que la molécule est saturée.
Les alcanes à chaîne carbonée linéaire
• Les atomes de carbone se trouvent les uns à la suite des autres. Il n'y a pas de ramifications.
• La formule brute d'un alcane non cyclique peut s'écrire CnH2n+2.
• Les six premiers alcanes portent des noms usuels. Les alcanes suivants portent des noms qui indiquent en préfixe leur nombre d'atomes de carbone, avec à la suite la terminaison « -ane ».
| Nombre d'atome(s) de carbone | Nom de l'alcane | Formule brute | Formule semi-développée |
| 1 | méthane | CH4 | CH4 |
| 2 | éthane | C2H6 | CH3-CH3 |
| 3 | propane | C3H8 | CH3-CH2-CH3 |
| 4 | butane | C4H10 | CH3-CH2-CH2-CH3 |
| 5 | pentane | C5H12 | CH3-CH2-CH2-CH2-CH3 |
| 6 | hexane | C6H14 | CH3-CH2-CH2-CH2-CH2-CH3 |
Les alcanes à chaîne carbonée ramifiée
• À partir de quatre atomes de carbone, le squelette peut compter des ramifications. Un alcane ramifié est formé d'une chaîne principale sur laquelle se fixent des groupes.
| CH3- | CH3-CH2- | CH3-CH2-CH2- | CH3—(CH2)2-CH2- | CH3—(CH2)3-CH2- | CH3—(CH2)4-CH2- |
| groupe méthyle | groupe éthyle | groupe propyle | groupe butyle | groupe pentyle | groupe hexyle |
- Étape 1 : on cherche la chaîne carbonée la plus longue. C'est elle qui donne son nom à l'alcane.
- Étape 2 : en préfixe, on ajoute le nom (sans le « e » final) du groupe fixé sur la chaîne principale. On repère sa position en numérotant la chaîne principale, afin de donner le plus petit nombre au carbone qui porte le groupe. Ce nom est placé devant le nom du groupe.
- Étape 3 : lorsqu'il y a plusieurs groupes identiques, on place le préfixe di-, tri-, tétra- devant le nom du groupe.
- Étape 4 : lorsqu'il y a des groupes différents, on les nomme dans l'ordre alphabétique. Le plus petit nombre étant affecté au groupe placé en tête dans l'ordre alphabétique.
• On note que dans le nom d'une molécule organique en général, deux chiffres sont obligatoirement séparés par une virgule alors qu'un chiffre et une lettre le sont par un tiret. Le nom complet forme un mot unique (donc pas d'espace).
• Les groupements alkyles s'écrivent sans leur « e » final dans le nom d'une molécule.
Exercice n°1Les alcanes à chaîne cyclique
• Leur formule brute n'est plus de la forme CnH2n+2. On les nomme en ajoutant devant le nom de l'alcane le préfixe « cyclo ».
II. Qu'est-ce qu'un alcool ?
Qu'est-ce qu'un alcool ?
• Les alcools sont des molécules organiques possédant un squelette carboné de type alcane sur lequel se trouve greffé un groupement hydroxyle − OH.
• L'atome de carbone sur lequel est fixé le groupement hydroxyle est appelé carbone fonctionnel.
Comment nomme-t-on un alcool ?
• Leur nom dérive de l'alcane correspondant en remplaçant la terminaison « -ane » par la terminaison « −anol ». On numérotera la position du groupement − OH dans la chaîne carbonée, et celui-ci est prioritaire devant les ramifications.
| Nombre d'atome(s) de | Nom de l'alcool | Formule brute | Formule semi-développée | |
| 1 | méthanol | CH4O | CH3—OH | |
| 2 | éthanol | C2H6O | CH3—CH2—OH | |
| 3 | propanol | C3H8O | propan-1-ol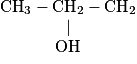 | propan-2-ol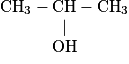 |
• Le propan-1-ol et le propan-2-ol sont appelés isomères, car ils ont la même formule brute mais des formules semi-développées différentes.
Exercice n°2III. Les composés carbonylés
Les aldéhydes
• Les aldéhydes sont des molécules organiques possédant un squelette carboné de type alcane sur lequel on trouve un groupement carbonyle en bout de chaîne carbonée.
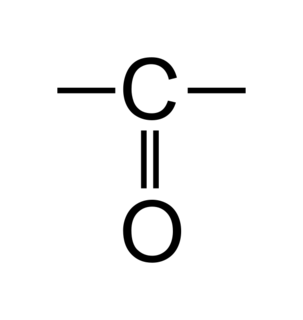 |
• L'atome de carbone sur lequel est fixé le groupement carbonyle est appelé carbone fonctionnel.
• On choisit le sens de numérotation de la chaîne carbonée de façon à attribuer au carbone fonctionnel le chiffre le plus petit possible.
Les cétones
• Les cétones sont des molécules organiques possédant un squelette carboné de type alcane sur lequel on trouve un groupement carbonyle qui ne doit pas être en bout de chaîne carbonée.
• L'atome de carbone sur lequel est fixé le groupement carbonyle est appelé carbone fonctionnel.
• Le carbone fonctionnel ne pourra donc pas se trouver en position « 1 » dans une cétone. La plus petite cétone possible est donc la propanone :
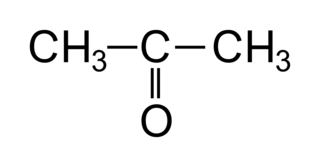 |
• Ici on ne précise pas le numéro du carbone fonctionnel, car le groupe fonctionnel ne peut pas être placé autre part vu qu'il ne peut pas être en bout de chaîne.
Exercice n°3IV. Les acides carboxyliques
• Les acides carboxyliques sont des molécules organiques possédant un squelette carboné de type alcane sur lequel on trouve en bout de chaîne un groupement carboxyle :
 |
• Dans un acide carboxylique, le carbone fonctionnel est forcément en bout de chaîne. Il ne faut donc pas préciser sa position qui sera forcément dans tous les cas « 1 ».
| Nombre d'atome(s) de carbone | Nom de l'acide | Formule brute | Formule semi-développée |
| 1 | acide méthanoïque | CH2O2 | H—COOH |
| 2 | acide éthanoïque | C2H4O2 | CH3—COOH |
| 3 | acide propanoïque | C3H6O2 | CH3—CH2—COOH |
V. La spectroscopie infrarouge
Qu'est-ce que c'est ?
• En abscisse, de droite à gauche, on a le nombre d'onde, noté σ, qui correspond à l'inverse de longueur d'onde λ. On l'exprime souvent en cm−1.
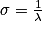 .
.
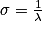 .
.• En général, le spectre s'étend de 400 à 4 000 cm−1.
• En ordonnée, on a la transmittance T exprimée en %. Une transmittance proche de 100 % signifie qu'il n'y a pas d'absorption. Les bandes d'absorption d'un spectre IR pointent donc vers le bas. La transmittance est définie comme : 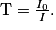
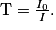
• Sur un spectre IR, on visualise des bandes ou des pics d'absorption. Chaque bande est associée à une liaison chimique entre deux atomes. On pourra ainsi identifier des groupes caractéristiques.
Analyse d'un spectre IR
• À partir d'un exemple de spectre IR, comme ci-dessous, on peut extraire quelques informations générales :
 |
• Entre 4 000 cm−1 et 1 500 cm−1 : ces bandes ou ces pics correspondent à l'absorption IR par des liaisons simples (single bonds stretch entre 4 000 cm−1 et 2 500 cm−1), par des liaisons triples ou par des liaisons doubles.
• Ces pics ou bandes sont caractérisés par leur position (abscisse), leur intensité et leur largeur. Les renseignements précis sont donnés dans des tables spectroscopiques.
• Entre 1 500 et 400 cm−1 : cette zone est plus complexe ; elle est appelée empreinte digitale de la molécule. Elle est caractéristique de la molécule, mais il est en général difficile d'attribuer les pics observés à des groupes d'atomes précis.
• Pour étudier un spectre IR :
- relever la valeur de l'abscisse des bandes entre 4 000 et 1 500 cm−1 et noter l'allure de la bande (largeur, intensité) ;
- les comparer avec les données fournies dans une table d'absorptions caractéristiques ;
- déduire la nature de la liaison chimique responsable de cette bande d'absorption.
La liaison hydrogène
• Sur la partie du spectre IR du butan-1-ol en phase gazeuse (en haut), puis en phase liquide (en bas), on remarque que la fine bande d'absorption située à 3 000 cm−1, et due à la liaison O–H, est modifiée quand l'échantillon est analysé en phase liquide. En effet, on remarque alors une deuxième bande plus large et intense vers 3 300 cm−1, qui recouvre en partie la première bande.
• Cette bande met en évidence la présence de liaisons hydrogène entre l'atome d'oxygène d'une molécule d'alcool et l'atome d'hydrogène d'une autre molécule d'alcool qui provoque l'élargissement de la bande d'absorption.
 |
À savoir et savoir réaliser :
- Savoir déterminer les formules brutes et les formules semi-développées de molécules ;
- Identifier, à partir d'une formule semi-développée, les groupes caractéristiques associés aux familles de composés : alcool, aldéhyde, cétone et acide carboxylique.
- Savoir ce qu'est un squelette carboné saturé.
- Justifier le nom associé à la formule semi-développée de molécules simples possédant un seul groupe caractéristique et inversement.
- Exploiter, à partir de valeurs de référence, un spectre d'absorption infrarouge et identifier les groupes caractéristiques avec un spectre d'absorption infrarouge.
Exercice n°1
Comment s'appelle la molécule suivante ?
 |
Cochez la bonne réponse.
| ||
| ||
| ||
|
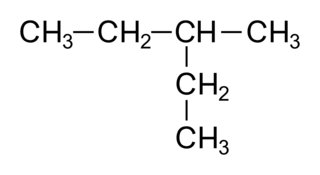
La chaîne la plus longue de la molécule comporte 5 carbones. Son nom dérivera de l'alcane, le pentane. Il y a un groupe méthyle. On numérote alors dans les deux sens la chaîne carbonée et on choisit le plus petit numéro pour le groupe méthyle, donc 3. Le nom est 3-méthylpentane.
Exercice n°2
Comment s'appelle la molécule suivante ?
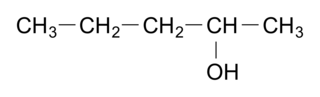 |
Cochez la bonne réponse.
| ||
| ||
| ||
| ||
| ||
| ||
| ||
|
La molécule comporte 5 carbones. Son nom dérivera de l'alcane, le pentane. Il s'agit d'un alcool : on aura la terminaison « ol ». On numérote alors dans les deux sens la chaîne carbonée et on choisit le plus petit numéro pour le groupe fonctionnel, donc 2. Le nom est pentan-2-ol.
Exercice n°3
Comment s'appelle la molécule suivante ?
 |
Cochez la bonne réponse.
| ||
| ||
| ||
|
La molécule comporte 4 carbones. Son nom dérivera de l'alcane, le butane. Il s'agit d'une cétone puisque le carbone fonctionnel n'est pas en bout de chaîne : on aura la terminaison « one ». On numérote alors dans les deux sens la chaîne carbonée et on choisit le plus petit numéro pour le groupe fonctionnel, donc 2. Le nom est butan-2-one.
Exercice n°4
Comment s'appelle la molécule suivante ?
 |
Cochez la bonne réponse.
| ||
| ||
| ||
| ||
|
La molécule comporte 4 carbones. Son nom dérivera de l'alcane, le butane. Il s'agit d'un acide carboxylique : on aura la terminaison « oique ». Le carbone fonctionnel portera le numéro 1. Il y a deux ramifications : un groupe éthyle sur le deuxième carbone et un groupe méthyle sur le troisième. On choisit l'ordre alphabétique pour le groupe alkyle. Le nom est : acide 2-éthyl-3-méthylbutanoique.
Exercice n°5
Parmi les affirmations suivantes, laquelle est correcte ?
Cochez la bonne réponse.
| ||
| ||
|
Le spectre infrarouge d'une molécule permet d'avoir des indications sur certains groupes caractéristiques : comme le groupe hydroxyle −OH, le groupe carbonyle 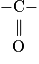 présent dans les aldéhydes, les cétones ou les acides carboxyliques. En dessous de 1 500 cm−1, on se trouve dans l'empreinte de la molécule : elle ne donne pas d'indications intéressantes pour l'identification de la molécule. Le groupe −OH, à cause des liaisons hydrogène, donne un pic intense et large mais au-dessus de 3 200 cm−1.
présent dans les aldéhydes, les cétones ou les acides carboxyliques. En dessous de 1 500 cm−1, on se trouve dans l'empreinte de la molécule : elle ne donne pas d'indications intéressantes pour l'identification de la molécule. Le groupe −OH, à cause des liaisons hydrogène, donne un pic intense et large mais au-dessus de 3 200 cm−1.
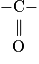 présent dans les aldéhydes, les cétones ou les acides carboxyliques. En dessous de 1 500 cm−1, on se trouve dans l'empreinte de la molécule : elle ne donne pas d'indications intéressantes pour l'identification de la molécule. Le groupe −OH, à cause des liaisons hydrogène, donne un pic intense et large mais au-dessus de 3 200 cm−1.
présent dans les aldéhydes, les cétones ou les acides carboxyliques. En dessous de 1 500 cm−1, on se trouve dans l'empreinte de la molécule : elle ne donne pas d'indications intéressantes pour l'identification de la molécule. Le groupe −OH, à cause des liaisons hydrogène, donne un pic intense et large mais au-dessus de 3 200 cm−1.

