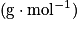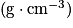Grâce à sa maîtrise des techniques expérimentales, le chimiste est capable de synthétiser de nouvelles molécules et de fabriquer des matériaux innovants qui répondent aux besoins et aux évolutions de la société. Comment se déroule une synthèse organique ? Sur quels critères s'effectue le choix des paramètres expérimentaux et des techniques mises en œuvre ? Qu'est-ce que le rendement d'une synthèse et comment le calculer ?
I. Quelles sont les différentes étapes d'une synthèse organique ?
• La synthèse d'une espèce chimique se décompose en quatre étapes successives :
- La réaction chimique s'effectue dans un réacteur (ballon ou erlenmeyer) dans lequel sont introduits les réactifs ainsi que le solvant et le catalyseur éventuel. À la fin de la réaction, le réacteur contient un mélange d'espèces chimiques, dont le produit recherché.
- L'étape d'extraction consiste à isoler le produit recherché des autres espèces présentes dans le milieu réactionnel (réactifs n'ayant pas réagi, produits secondaires, catalyseur, solvant). On obtient un produit brut, contenant des impuretés en faible quantité.
- Le produit brut subit une étape de purification consistant à éliminer les impuretés afin d'obtenir un produit purifié.
- Enfin, les étapes d'analyse permettent de contrôler la nature et la pureté du produit synthétisé.
• Le descriptif des manipulations à effectuer lors de ces différentes étapes constitue le protocole expérimental de la synthèse organique.
II. Comment identifier les espèces mises en jeu et déterminer leurs quantités respectives ?
• Les espèces introduites dans le réacteur sont les réactifs, ainsi que le solvant et le catalyseur éventuel. Le plus souvent, un des réactifs est introduit en excès (généralement le moins cher) afin d'améliorer le rendement de la réaction. Il est donc nécessaire de déterminer les quantités de matière de chacun des réactifs :
- Solide :
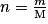 , avec m la masse (g) et M la masse molaire
, avec m la masse (g) et M la masse molaire 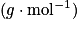 .
. - Liquide :
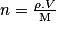 , avec ρ la masse volumique
, avec ρ la masse volumique 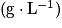 , V le volume (L) et M la masse molaire
, V le volume (L) et M la masse molaire 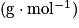 .
. - Solution :
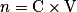 , avec C la concentration
, avec C la concentration 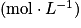 et V le volume (L).
et V le volume (L).
• Le réactif limitant est celui conduisant à l'avancement maximal le plus faible.
III. Sur quels critères s'effectue le choix des paramètres expérimentaux ?
• Les paramètres expérimentaux influencent le déroulement de la réaction chimique et sont choisis de façon à optimiser la synthèse organique :
- L'ajout d'un solvant éventuel permet de solubiliser les réactifs et d'obtenir un mélange réactionnel homogène, notamment lorsque les réactifs sont peu miscibles entre eux.
- Dans le cas de transformations lentes, on agit sur les facteurs cinétiques afin d'augmenter la vitesse de réaction : ajout d'un catalyseur spécifique et/ou augmentation de la température par chauffage du milieu réactionnel.
- Le contrôle du pH est également un facteur important pour les réactions s'effectuant en milieu acide ou basique.
• Un catalyseur est une espèce chimique qui augmente la vitesse de la réaction donc qui diminue la durée de la réaction.
IV. Comment justifier le choix des techniques mises en œuvre ?
Le choix des techniques mises en œuvre lors des différentes étapes d'une synthèse organique découle essentiellement des propriétés physico-chimiques des espèces mises en jeu.
Étape 1 : réaction chimique
• La plupart des réactions chimiques nécessitent un chauffage, pour diverses raisons : augmentation de la vitesse de réaction, solubilisation des réactifs, augmentation du rendement de certaines réactions limitées…
Afin d'éviter les pertes de matière par évaporation, le réacteur doit être surmonté d'un réfrigérant (à eau ou à air) permettant de condenser les vapeurs dégagées, qui retombent ensuite dans le réacteur. Ce type de montage s'appelle un chauffage à reflux. En fin de réaction, le mélange réactionnel est refroidi en plaçant le réacteur dans un bain de glace.
• Le choix du type de réfrigérant dépend de la température de chauffe et des températures d'ébullition des différentes espèces chimiques présentes dans le réacteur :
- Si la température de chauffe est modérée vis-à-vis des températures d'ébullition des différents composés, un réfrigérant à air est suffisant.
- Si les températures d'ébullition sont largement dépassées, on utilisera plutôt un réfrigérant à eau, qui présente un pouvoir de condensation supérieur.
• Certaines réactions très exothermiques ne nécessitent pas de chauffage, la chaleur dégagée par la réaction étant suffisante. Il est même parfois nécessaire de réguler la température en plaçant le réacteur dans un bain d'eau glacée.
Exercice n°1Exercice n°2Étape 2 : extraction ou isolement du produit
• Différentes techniques d'extraction sont employées en fonction de l'état physique du produit à isoler. Elles sont essentiellement basées sur les propriétés de solubilité.
• La filtration sous pression réduite permet d'isoler une espèce chimique dissoute dans un mélange. Le refroidissement du milieu réactionnel ou la modification de son pH entraîne une diminution de la solubilité de l'espèce et conduit à sa précipitation. La récupération de la phase solide s'effectue à l'aide d'une fiole à vide munie d'un entonnoir Büchner permettant une filtration rapide et un essorage efficace sous pression réduite. Le réacteur doit être rincé pour récupérer la totalité du produit, et le solide doit être lavé pour éliminer le maximum d'impuretés. Le solvant de rinçage doit être refroidi afin d'éviter la dissolution du produit.
• L'extraction liquide-liquide permet de transférer une espèce chimique dissoute dans un solvant vers un autre solvant (appelé solvant extracteur) non miscible au premier et dans lequel l'espèce à extraire est plus soluble. La récupération du solvant extracteur contenant l'espèce à extraire s'effectue par décantation dans une ampoule à décanter, permettant de séparer les différentes phases selon leur densité (la phase supérieure étant la moins dense).
• La séparation est généralement suivie des étapes suivantes :
Exercice n°3- séchage de la phase organique à l'aide d'un agent dessiccant (sulfate de magnésium anhydre par exemple) afin d'éliminer les traces d'eau résiduelles ;
- évaporation du solvant sous pression réduite à l'aide d'un évaporateur rotatif.
Étape 3 : purification du produit obtenu
• Les deux méthodes de purification les plus employées sont la recristallisation pour les solides et la distillation pour les liquides.
• La distillation s'effectue grâce à la différence de température d'ébullition entre le produit et les impuretés. Si le produit à purifier possède la température d'ébullition la plus basse, il est séparé du mélange par évaporation, puis condensé et récupéré sous forme de distillat.
• La recristallisation est fondée sur la différence de solubilité à chaud et à froid du produit et des impuretés dans un solvant bien choisi. Le produit brut est dissous à chaud dans le minimum de solvant, puis le mélange est laissé à refroidir lentement. Les impuretés sont solubles à froid dans le solvant, alors que le produit cristallise et peut ainsi être récupéré par filtration.
Exercice n°3Étape 4 : analyse du produit obtenu
• Plusieurs méthodes d'analyse sont envisageables :
- Mesure de grandeurs physico-chimiques caractéristiques : température de fusion (sur banc Köfler) pour les solides, densité, indice de réfraction ou température d'ébullition pour les liquides.
- Chromatographie sur couche mince (CCM).
- Chromatographie sur colonne.
- Analyse spectrale : UV (pour les espèces colorées), IR et RMN.
V. Qu'est-ce que le rendement ?
• Le rendement d'une synthèse organique est défini comme le rapport entre la quantité de matière de produit P effectivement obtenu après purification nPet la quantité de matière nmax que l'on pourrait obtenir si la réaction était totale : 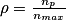 .
.
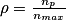 .
.• Le rendement est souvent exprimé en pourcentage. Compris entre 0 et 1, il est toujours inférieur au taux d'avancement final, car les étapes d'isolement et de purification entraînent nécessairement des pertes de matière. Sa valeur dépend fortement des paramètres expérimentaux de la synthèse : température, durée du chauffage, homogénéité du milieu réactionnel, présence d'un réactif en excès…
• Un grand nombre de synthèses organiques nécessitent plusieurs réactions chimiques successives : on parle de synthèses multi-étapes. Le rendement global de la synthèse est égal au produit des rendements de chaque étape intermédiaire. Idéalement, ces rendements doivent être les plus proches possible de 1 afin que le rendement global reste acceptable.
• Le rendement est un indicateur d'efficacité important dans le cadre des applications industrielles. Associé au coût de revient, il permet d'apprécier la rentabilité économique d'une synthèse.
• Si tout doit être mis en œuvre afin d'obtenir le meilleur rendement possible, il faut également prendre en compte les aspects liés à la sécurité (notamment en respectant les consignes de sécurité relatives aux espèces chimiques utilisées) et à l'impact environnemental de la synthèse effectuée.
Exercice n°5À savoir et savoir réaliser :
- Identifier, dans un protocole, les étapes de transformation des réactifs et d'isolement, de purification et d'analyse (identification, pureté) du produit synthétisé.
- Justifier, à partir des propriétés physico-chimiques des réactifs et produits, le choix de méthodes d'isolement, de purification ou d'analyse.
- Déterminer, à partir d'un protocole et de données expérimentales, le rendement d'une synthèse.
Exercice n°1
Les étapes du protocole expérimental de la synthèse de l'acide acétylsalicylique (plus communément appelé aspirine) à partir de l'acide salicylique et de l'anhydride éthanoïque sont données dans le désordre :
A. Les cristaux récupérés contiennent des impuretés. Les purifier par recristallisation. Filtrer de nouveau sur Büchner et sécher à l'étuve.
B. Introduire dans un ballon 6,0 g d'acide salicylique, 12 mL d'anhydride éthanoïque et quelques gouttes d'acide sulfurique. Chauffer à reflux pendant 30 minutes.
C. Mesurer le point de fusion des cristaux obtenus.
D. Ajouter de l'eau froide dans le milieu réactionnel. Filtrer le mélange obtenu sur Büchner et récupérer les cristaux d'aspirine.
Quel est l'ordre correct des étapes de cette synthèse organique ?
A. Les cristaux récupérés contiennent des impuretés. Les purifier par recristallisation. Filtrer de nouveau sur Büchner et sécher à l'étuve.
B. Introduire dans un ballon 6,0 g d'acide salicylique, 12 mL d'anhydride éthanoïque et quelques gouttes d'acide sulfurique. Chauffer à reflux pendant 30 minutes.
C. Mesurer le point de fusion des cristaux obtenus.
D. Ajouter de l'eau froide dans le milieu réactionnel. Filtrer le mélange obtenu sur Büchner et récupérer les cristaux d'aspirine.
Quel est l'ordre correct des étapes de cette synthèse organique ?
Cochez la bonne réponse.
| ||
| ||
| ||
| ||
|
Le protocole expérimental fait apparaître les quatre étapes d'une synthèse organique : la réaction chimique, l'extraction du produit brut, la purification et l'analyse du produit pur.
Le protocole de la synthèse de l'aspirine est donc :
B : Introduire dans un ballon 6,0 g d'acide salicylique, 12 mL d'anhydride éthanoïque et quelques gouttes d'acide sulfurique. Chauffer à reflux pendant 30 minutes.
D : Ajouter de l'eau froide dans le milieu réactionnel. Filtrer le mélange obtenu sur Büchner et récupérer les cristaux d'aspirine.
A : Les cristaux récupérés contiennent des impuretés. Les purifier par recristallisation. Filtrer de nouveau sur Büchner et sécher à l'étuve.
C : Mesurer le point de fusion des cristaux obtenus.
Le protocole de la synthèse de l'aspirine est donc :
B : Introduire dans un ballon 6,0 g d'acide salicylique, 12 mL d'anhydride éthanoïque et quelques gouttes d'acide sulfurique. Chauffer à reflux pendant 30 minutes.
D : Ajouter de l'eau froide dans le milieu réactionnel. Filtrer le mélange obtenu sur Büchner et récupérer les cristaux d'aspirine.
A : Les cristaux récupérés contiennent des impuretés. Les purifier par recristallisation. Filtrer de nouveau sur Büchner et sécher à l'étuve.
C : Mesurer le point de fusion des cristaux obtenus.
Exercice n°2
Le benzoate de méthyle, utilisé en parfumerie et présent dans de nombreuses huiles essentielles naturelles, est obtenu par réaction d'estérification entre l'acide benzoïque et le méthanol en présence d'acide sulfurique, selon la réaction :
C6H5COOH + CH3OH = C6H5COOCH3 + H2O.
Dans un ballon, on introduit 12,2 g d'acide benzoïque, 20 mL de méthanol, 3 mL d'acide sulfurique concentré et quelques grains de pierre ponce. Le mélange est chauffé à reflux pendant une heure.
Quel est le réactif limitant ?
Données :
C6H5COOH + CH3OH = C6H5COOCH3 + H2O.
Dans un ballon, on introduit 12,2 g d'acide benzoïque, 20 mL de méthanol, 3 mL d'acide sulfurique concentré et quelques grains de pierre ponce. Le mélange est chauffé à reflux pendant une heure.
Quel est le réactif limitant ?
Données :
| Espèce chimique | Formule brute | Masse molaire 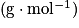 | Masse volumique 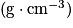 |
| Acide benzoïque | C6H5COOH | 122 | 1,3 |
| Méthanol | CH3OH | 32 | 0,8 |
| Acide sulfurique | H2SO4 | 98 | 1,8 |
| Benzoate de méthyle | C6H5COOCH3 | 136 | 1,1 |
Cochez la (ou les) bonne(s) réponse(s).
| ||
| ||
| ||
|
Les deux réactifs sont l'acide benzoïque et le méthanol. L'acide sulfurique joue le rôle de catalyseur afin d'accélérer la réaction, car l'estérification est une réaction lente. Le benzoate de méthyle est l'un des produits de la réaction.Calculons les quantités de matière respectives de chacun des réactifs :
Acide benzoïque (solide) :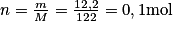 .
.
Méthanol (liquide) :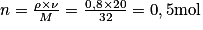 .
.
Le réactif limitant est celui conduisant à l'avancement maximal le plus faible :
Si l'acide benzoïque est limitant : 0,1 − xmax = 0 donc xmax = 0,1 mol.
Si le méthanol est limitant : 0,5 − xmax = 0 donc xmax = 0,5 mol.
L'acide benzoïque conduit à l'avancement maximal le plus faible, c'est donc le réactif limitant. Le méthanol est introduit en excès afin d'augmenter le rendement, car l'estérification est une réaction non totale.
Acide benzoïque (solide) :
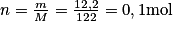 .
.Méthanol (liquide) :
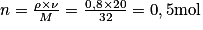 .
.Le réactif limitant est celui conduisant à l'avancement maximal le plus faible :
Si l'acide benzoïque est limitant : 0,1 − xmax = 0 donc xmax = 0,1 mol.
Si le méthanol est limitant : 0,5 − xmax = 0 donc xmax = 0,5 mol.
L'acide benzoïque conduit à l'avancement maximal le plus faible, c'est donc le réactif limitant. Le méthanol est introduit en excès afin d'augmenter le rendement, car l'estérification est une réaction non totale.
Exercice n°3
Le benzaldéhyde est une molécule extraite de l'essence d'amande amère, utilisée comme arôme pour des boissons ou des pâtisseries. On souhaite extraire le benzaldéhyde d'une solution aqueuse contenue dans un flacon d'arôme d'amande. Quel solvant peut-on utiliser dans le cadre d'une extraction liquide-liquide ?
| Solvant | Solubilité du benzaldéhyde | Miscibilité avec l'eau |
| Eau | Légèrement soluble | Miscible |
| Éthanol | Très soluble | Miscible |
| Acétone | Très soluble | Miscible |
| Éther | Très soluble | Non miscible |
Cochez la bonne réponse.
| ||
| ||
| ||
| ||
|
L'extraction liquide-liquide permet de transférer une espèce chimique dissoute dans un solvant vers un autre solvant (appelé solvant extracteur) non miscible au premier et dans lequel l'espèce à extraire est plus soluble.
Le benzaldéhyde est peu soluble dans l'eau, et très soluble dans l'éthanol, l'acétone et l'éther. L'éthanol et l'acétone sont miscibles à l'eau, et ne peuvent donc pas être utilisés comme solvant extracteur. En revanche, l'éther est non miscible à l'eau et réunit ainsi toutes les conditions pour pouvoir être utilisé comme solvant pour l'extraction de la solution aqueuse de benzaldéhyde.
Le benzaldéhyde est peu soluble dans l'eau, et très soluble dans l'éthanol, l'acétone et l'éther. L'éthanol et l'acétone sont miscibles à l'eau, et ne peuvent donc pas être utilisés comme solvant extracteur. En revanche, l'éther est non miscible à l'eau et réunit ainsi toutes les conditions pour pouvoir être utilisé comme solvant pour l'extraction de la solution aqueuse de benzaldéhyde.
Exercice n°4
On effectue la synthèse de l'acétate de 3-méthylbutyle (plus connu sous le nom d'acétate d'isoamyle), ester à odeur de banane se présentant sous la forme d'un liquide transparent incolore. Quelles sont les méthodes permettant l'analyse de ce produit ?
Cochez la (ou les) bonne(s) réponse(s).
| ||
| ||
| ||
|
Le produit étant un liquide incolore, on peut envisager les méthodes d'analyse suivantes :
Mesure de grandeurs physico-chimiques caractéristiques : densité, indice de réfraction ou température d'ébullition (la mesure du point de fusion est réservée aux solides).
Chromatographie sur couche mince (CCM).
Analyse spectrale : IR et RMN (la spectroscopie UV est réservée aux espèces absorbant dans le visible donc colorées).
Mesure de grandeurs physico-chimiques caractéristiques : densité, indice de réfraction ou température d'ébullition (la mesure du point de fusion est réservée aux solides).
Chromatographie sur couche mince (CCM).
Analyse spectrale : IR et RMN (la spectroscopie UV est réservée aux espèces absorbant dans le visible donc colorées).
Exercice n°5
L'acide benzoïque peut être synthétisé par oxydation du benzaldéhyde par le permanganate suivant la réaction :
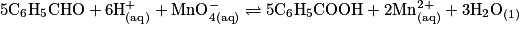 .
.
On réalise l'oxydation d'un volume V = 4,0 mL de benzaldéhyde par une masse m = 3,16 g de permanganate de potassium KMnO4 en présence d'un excès d'acide sulfurique. Après extraction et purification, on obtient 3,9 g d'acide benzoïque solide. Quel est le rendement de la synthèse ?
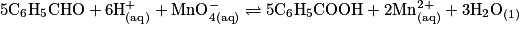 .
.On réalise l'oxydation d'un volume V = 4,0 mL de benzaldéhyde par une masse m = 3,16 g de permanganate de potassium KMnO4 en présence d'un excès d'acide sulfurique. Après extraction et purification, on obtient 3,9 g d'acide benzoïque solide. Quel est le rendement de la synthèse ?
Cochez la bonne réponse.
| ||||||||||||||||||||||
| ||||||||||||||||||||||
| ||||||||||||||||||||||
| ||||||||||||||||||||||
|
Calculons les quantités de matière respectives de chacun des réactifs :
Permanganate de potassium (solide) :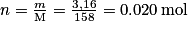 .
.
Benzaldéhyde (liquide) :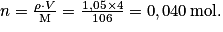
Le réactif limitant est celui conduisant à l'avancement maximal le plus faible :
Si le permanganate est limitant : 0,020 − 2xmax = 0 donc xmax = 0,010 mol.
Si le benzaldéhyde est limitant : 0,040 − 5xmax = 0 donc xmax = 0,0080 mol.
Le benzaldéhyde conduit à l'avancement maximal le plus faible (0,0080 mol) : il s'agit donc du réactif limitant.
Le rendement d'une synthèse organique est défini comme le rapport entre la quantité de matière de produit P effectivement obtenu après purification nP et la quantité de matière nmax que l'on pourrait obtenir si la réaction était totale :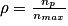 . Il est toujours compris entre 0 et 1 (soit entre 0 et 100 %).
. Il est toujours compris entre 0 et 1 (soit entre 0 et 100 %).
Calculons la quantité de matière d'acide benzoïque obtenu :
Réellement (après purification) :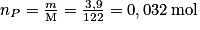 .
.
Si la réaction était totale :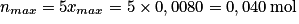 .
.
Le rendement de la synthèse est donc :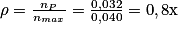 soit 80 %.
soit 80 %.
Permanganate de potassium (solide) :
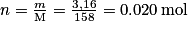 .
.Benzaldéhyde (liquide) :
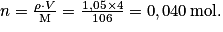
Le réactif limitant est celui conduisant à l'avancement maximal le plus faible :
Si le permanganate est limitant : 0,020 − 2xmax = 0 donc xmax = 0,010 mol.
Si le benzaldéhyde est limitant : 0,040 − 5xmax = 0 donc xmax = 0,0080 mol.
Le benzaldéhyde conduit à l'avancement maximal le plus faible (0,0080 mol) : il s'agit donc du réactif limitant.
Le rendement d'une synthèse organique est défini comme le rapport entre la quantité de matière de produit P effectivement obtenu après purification nP et la quantité de matière nmax que l'on pourrait obtenir si la réaction était totale :
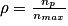 . Il est toujours compris entre 0 et 1 (soit entre 0 et 100 %).
. Il est toujours compris entre 0 et 1 (soit entre 0 et 100 %).Calculons la quantité de matière d'acide benzoïque obtenu :
Réellement (après purification) :
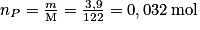 .
.Si la réaction était totale :
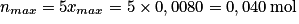 .
.Le rendement de la synthèse est donc :
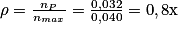 soit 80 %.
soit 80 %.