Les réactions de combustion fournissent l'énergie nécessaire à nos déplacements, à l'activité industrielle, à nos besoins de chauffage, à la production d'électricité… Elles dégagent de la chaleur, mais également des gaz nocifs pour l'environnement : le dioxyde de carbone qui contribue à l'effet de serre et au dérèglement climatique, les oxydes de soufre ou d'azote qui forment les pluies acides.
I. Les combustibles organiques usuels
• Un combustible est une espèce qui brûle.
• Les combustibles sont multiples : le gaz, le pétrole et ses dérivés, le bois, le charbon. Ils contiennent principalement des hydrocarbures, c'est-à-dire des combinaisons d'atomes de carbone et d'hydrogène, parfois d'oxygène.
• Ainsi le méthane qui est le constituant principal du gaz naturel est de formule : CH4. Un litre de fuel de masse moyenne égale à 880 g contient 726 g de carbone, 110 g d'hydrogène et 2 g de soufre.
• On distingue trois grandes catégories de combustibles :
- Les combustibles solides comme le charbon, le bois…
- Les combustibles liquides comme le GPL, le fioul, le diesel, l'essence… qui sont dérivés du pétrole, le bioéthanol qui dérive de la biomasse.
- Les combustibles gazeux comme le gaz naturel issu des hydrocarbures, mais également du biométhane produit par la méthanisation de matière organique.
• On distingue également :
- Les combustibles fossiles issus de matières organiques préhistoriques fossilisées qui ne se renouvellent pas, comme le pétrole et ses dérivés.
- Les biocombustibles issus de plantes vivantes qui se renouvellent comme le bioéthanol.
II. Comment peut-on modéliser une combustion ?
• En chimie, la combustion désigne une réaction chimique au cours de laquelle un corps est oxydé. Le corps qui est oxydé est appelé combustible et l'espèce qui oxyde est appelée comburant.
• Les réactions d'oxydation sont généralement très exothermiques ; c'est-à-dire qu'elles dégagent de la chaleur. On parle de combustion lorsque la réaction est suffisamment rapide pour qu'elle se matérialise par une flamme ou des étincelles.
• Deux produits principaux résultent d'une combustion : le dioxyde de carbone, CO2 et l'eau, H2O.
• Ainsi pour la combustion du méthane, on aura :
CH4 + 2O2 → CO2 + H2O.
CH4 + 2O2 → CO2 + H2O.
• En généralisant, pour un hydrocarbure de formule brute CxHy, on aura :
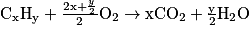 .
.
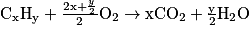 .
.• Exemple : On peut estimer la masse de dioxyde de carbone produit par un moteur à explosion.
L'essence est modélisée par l'octane (C8H18). Une voiture essence consomme un volume V = 5,3 L sur un parcours de 100 km.
Données : masse volumique de l'octane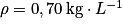 ;
;
masses molaires atomiques :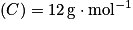 ;
; 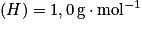 ;
; 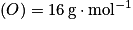 .
.
L'équation de réaction donne : 2C8H18+25O2→16CO2+18H2O.
Le réactif limitant est l'octane. D'après les stœchiométries des réactions, on a :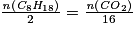 .
.
Or la quantité de carburant consommée est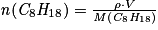 .
.
D'où :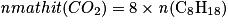
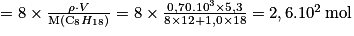 .
.
Soit m(CO2) = n(CO2) × M(CO2) = 2,6.102 × (12 + 2 × 16) = 1,1.104g = 11 kg.
Et pour la combustion de l'éthanol, on aura :
C2H6O + 3O2 → 2CO2 + 3H2O.
En généralisant, pour un alcool de formule brute : CxHyO, on aura :
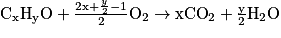 .
.
Exercice n°2Exercice n°3Exercice n°4Exercice n°5
L'essence est modélisée par l'octane (C8H18). Une voiture essence consomme un volume V = 5,3 L sur un parcours de 100 km.
Données : masse volumique de l'octane
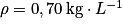 ;
;masses molaires atomiques :
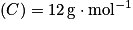 ;
; 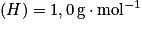 ;
; 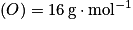 .
.L'équation de réaction donne : 2C8H18+25O2→16CO2+18H2O.
Le réactif limitant est l'octane. D'après les stœchiométries des réactions, on a :
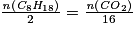 .
.Or la quantité de carburant consommée est
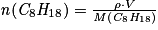 .
.D'où :
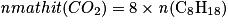
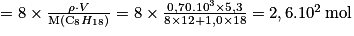 .
.Soit m(CO2) = n(CO2) × M(CO2) = 2,6.102 × (12 + 2 × 16) = 1,1.104g = 11 kg.
Et pour la combustion de l'éthanol, on aura :
C2H6O + 3O2 → 2CO2 + 3H2O.
En généralisant, pour un alcool de formule brute : CxHyO, on aura :
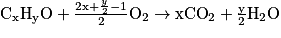 .
. Exercice n°2Exercice n°3Exercice n°4Exercice n°5
III. Comment calculer l'énergie libérée lors d'une combustion ?
Énergie de réaction, origine
La rupture des liaisons chimiques d'une molécule nécessite un apport d'énergie. La formation des liaisons chimiques d'une molécule libère de l'énergie. La variation d'énergie chimique d'un système est la résultante de toutes ces modifications.Énergie de réaction, convention de signe
• Une réaction qui libère de l'énergie est dite exothermique. Une réaction qui absorbe de l'énergie est dite endothermique. Les réactions de changement d'état sont exothermiques ou endothermiques.
• On appelle énergie de réaction la variation d'énergie chimique qui accompagne la transformation d'un système siège d'une réaction chimique.
• Une réaction exothermique correspond à une énergie de réaction négative. Une réaction endothermique correspond à une énergie de réaction positive. Une réaction athermique correspond à une énergie de réaction nulle.
Énergie de réaction et avancement
L'énergie chimique mise en jeu au cours de la transformation d'un système, siège d'une réaction chimique, est proportionnelle à l'avancement de cette réaction.Énergie molaire de réaction
L'énergie molaire de réaction d'une réaction chimique, Er ou Qr, est l'énergie chimique mise en jeu quand l'avancement de cette réaction augmente d'une mole. Elle s'exprime en joule par mole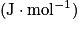 .
.Énergie libérée par une combustion
L'énergie libérée par une combustion est égale au produit de l'énergie molaire de réaction par le nombre de moles de combustible :Elib = n × Er
Où Elib est l'énergie libérée par la réaction de combustion en joule (J),
n est la quantité de matière en combustible (mol),
et Er est l'énergie molaire de réaction en
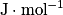 .
.Quelles interprétations microscopiques peut-on faire ?
• L'énergie d'une réaction chimique en phase gazeuse, c'est-à-dire qui ne met en jeu que des gaz, correspond à la variation de l'énergie chimique stockée dans les liaisons covalentes intramoléculaires.
• On imagine un cycle de transformations qui permet de passer des réactifs aux produits. Lors de la combustion du méthane, on aura :
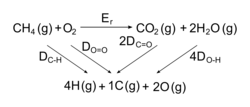 |
Tableau des énergies de liaison
| Liaison A − B | Énergie libérée par la formation de la liaison (kJ.mol−1) | Énergie consommée lors de la rupture de la liaison (kJ.mol−1) |
| C – H | − 415 | + 415 |
| C – C | − 345 | + 345 |
| C – O | − 356 | + 356 |
| O = O | − 498 | + 498 |
| C = O | − 798 | + 798 |
| O − H | − 463 | + 463 |
• On peut ainsi calculer l'énergie de réaction de la combustion du méthane :
Er = 4 DC-H + 2 DO=O − 4 DO-H − 2 DC=O
Er = 4 × 415 + 2 × 498 − 4 × 463 − 2 × 798
Er = − 792 kJ.mol−1 (exothermique).
Er = 4 DC-H + 2 DO=O − 4 DO-H − 2 DC=O
Er = 4 × 415 + 2 × 498 − 4 × 463 − 2 × 798
Er = − 792 kJ.mol−1 (exothermique).
• L'énergie molaire d'une réaction chimique, où les réactifs et produits sont tous à l'état gazeux, se détermine en faisant le bilan énergétique des liaisons rompues et des liaisons formées au cours de la réaction.
L'énergie molaire de réaction est égale à la somme des énergies des liaisons rompues moins la somme des énergies des liaisons formées, c'est-à-dire :
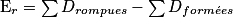
L'énergie molaire de réaction est égale à la somme des énergies des liaisons rompues moins la somme des énergies des liaisons formées, c'est-à-dire :
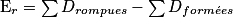
• L'énergie molaire de réaction est relative à une équation-bilan particulière.
• Si E > 0, la réaction est dite endothermique, c'est-à-dire que le système gagne de l'énergie par transfert de chaleur du milieu extérieur vers le système.
• Si E < 0, la réaction est dite exothermique, c'est-à-dire que le système perd de l'énergie par transfert de chaleur du système vers le milieu extérieur.
Exercice n°6
Exercice n°6
IV. Combustion et enjeu de société
Produits de la combustion complète et leurs dangers
• Toutes ces combustions produisent du dioxyde de carbone. C'est ce gaz qui est responsable du réchauffement de la planète. Il est principalement lié à l'utilisation des combustibles fossiles.
• Ainsi 1 m3 de gaz naturel produit 2 kg de dioxyde de carbone et 1 litre de fuel en produit 2,7 kg.
• De plus, l'air contient du diazote en grande quantité (78 % en volume). Lors des combustions, les atomes d'azote se combinent avec les atomes d'oxygène pour former des oxydes d'azote : NO, NO2, N2O… rassemblés sous la formule NOx. Ce sont ces gaz qui sont en partie responsables des pluies acides.
• Les combustibles contiennent également des traces d'autres éléments comme le soufre qui vont former après oxydation les oxydes de soufre : SO2, SO3… rassemblés sous la formule de SOx. Ce dernier oxyde formera de l'acide sulfurique par combinaison avec de l'eau contenue dans les nuages ou les fumées de combustion. Il entraînera également la formation de pluies acides.
Produits de la combustion incomplète et leurs dangers
• Si la quantité d'air et donc de dioxygène nécessaire à la combustion est insuffisante, on parle de combustion incomplète.
• La combustion de 1 m3 de gaz naturel a besoin d'environ 10 m3 d'air à 15 °C.
• Une combustion incomplète se traduit par la production d'imbrûlés, les suies, ou d'un gaz très dangereux, le monoxyde de carbone. Le monoxyde de carbone de formule CO est un gaz inodore, incolore et mortel, car il se fixe sur l'hémoglobine à la place du dioxygène, empêchant ainsi l'oxygénation des cellules.
Le pouvoir calorifique
• L'efficacité d'un combustible se mesure à l'aide de son pouvoir calorifique. On appelle pouvoir calorifique d'un combustible, la chaleur que peut dégager la combustion complète d'un kilogramme de combustible.
• On le note P ou PC. Son unité sera en kilojoule par kilogramme (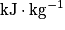 ) ou en joule par kilogramme (
) ou en joule par kilogramme (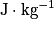 ).
).
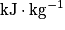 ) ou en joule par kilogramme (
) ou en joule par kilogramme (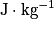 ).
).| Combustible | Pouvoir calorifique en 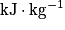 à 25 °C à 25 °C |
| Dihydrogène | 142 500 |
| Méthane | 55 600 |
| Butane | 47 600 |
| Éthanol | 28 800 |
| Essence | 42 500 |
| Charbon | 28 000 |
| Bois | 17 500 |
Transformation en énergie mécanique
Les machines à vapeur ou à combustion externe, ainsi que les moteurs à combustion interne convertissent l'énergie de réaction en énergie cinétique.À savoir et savoir réaliser :
- Citer des exemples de combustibles usuels.
- Savoir modéliser une combustion par une réaction d'oxydoréduction.
- Écrire l'équation de réaction de combustion complète d'un alcane et d'un alcool.
- Savoir définir l'énergie molaire de réaction, le pouvoir calorifique massique et l'énergie libérée lors d'une combustion.
- Savoir interpréter, microscopiquement en phase gazeuse, la modification des structures moléculaires, et les énergies de liaison.
- Estimer l'énergie molaire de réaction pour une transformation en phase gazeuse à partir de la donnée des énergies des liaisons.
- Citer des applications usuelles qui mettent en œuvre des combustions et les risques associés.
- Citer des axes d'étude actuels d'applications s'inscrivant dans une perspective de développement durable.
Exercice n°1
Quelle(s) est(sont) la(ou les) affirmation(s) vraie(s) ?
Cochez la (ou les) bonne(s) réponse(s).
| ||
| ||
| ||
|
L'énergie de réaction qui est de l'énergie chimique est contenue dans les molécules organiques. Elle peut ainsi être libérée lors des réactions. Lors des réactions chimiques, les molécules libèrent ou captent de l'énergie selon les liaisons rompues ou formées au cours de la réaction. Cette énergie peut être transformée en d'autres formes d'énergie comme l'énergie électrique ou thermique. Toutes les combustions sont exothermiques : c'est-à-dire qu'elles dégagent de la chaleur.
Exercice n°2
Une combustion complète d'un hydrocarbure peut libérer :
Cochez la (ou les) bonne(s) réponse(s).
| ||
| ||
| ||
| ||
|
Une combustion complète libère du dioxyde de carbone et de l'eau. Une combustion incomplète libère en plus du carbone et du monoxyde de carbone. Les oxydes d'azote ne sont pas libérés par la réaction de combustion : ce sont les atomes d'azote contenus dans l'air qui se combinent grâce à l'énergie dégagée par la combustion, avec les atomes d'oxygène pour former des oxydes d'azote.
Exercice n°3
Quelle est l'équation de combustion complète du butane :
Cochez la bonne réponse.
| ||
| ||
| ||
|
La molécule de butane contient 4 atomes de carbone et 10 atomes d'hydrogène. Il faut dans un premier temps équilibrer par rapport au nombre d'atomes de carbone en ajustant le nombre stœchiométrique devant la molécule de dioxyde de carbone. Puis on fait de même pour le nombre d'atomes d'hydrogène, en ajustant le nombre stœchiométrique devant la molécule d'eau. Or on arrive à une impossibilité d'équilibre des atomes d'oxygène : l'astuce est de multiplier par 2 tous les nombres stœchiométriques. La réaction met donc en jeu 8 atomes de carbone, 20 atomes d'hydrogène et 26 atomes d'oxygène.
Exercice n°4
L'équation de combustion complète du pentane est : C5H12(g) + 8O2(g)→ 5CO2 + 6H2O(g). La quantité de matière de dioxyde de carbone produit par la combustion de 5 mol de pentane est :
Cochez la bonne réponse.
| ||
| ||
| ||
|
D'après la stœchiométrie de la réaction, on a : 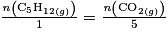 . Donc
. Donc 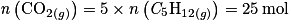 .
.
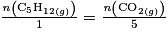 . Donc
. Donc 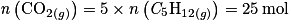 .
.Exercice n°5
L'équation de combustion complète du pentane est : C5H12(g) + 8O2(g)→ 5CO2 + 6H2O(g). La masse de dioxyde de carbone produit par la combustion de 5,3 L de pentane est :
Données : masse volumique de l'octane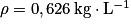 ;
;
masses molaires atomiques :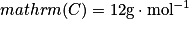 ;
; 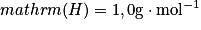 ;
; 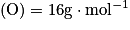 .
.
Données : masse volumique de l'octane
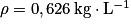 ;
;masses molaires atomiques :
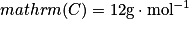 ;
; 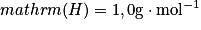 ;
; 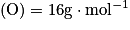 .
. Cochez la bonne réponse.
| ||
| ||
| ||
|
D'après la stoechiométrie de la réaction, on a : 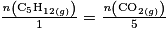 . Donc
. Donc 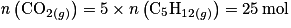 .
.
Or la quantité de carburant consommée est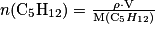
D'où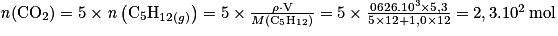
Soit m(CO2) = n(CO2) × M(CO2) = 2,3.102 × (12 + 2 × 16) = 1,0.104 g = 10 kg.
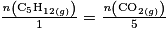 . Donc
. Donc 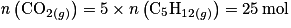 .
.Or la quantité de carburant consommée est
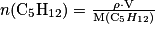
D'où
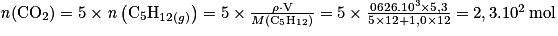
Soit m(CO2) = n(CO2) × M(CO2) = 2,3.102 × (12 + 2 × 16) = 1,0.104 g = 10 kg.
Exercice n°6
Parmi les affirmations suivantes, lesquelles sont correctes ?
Cochez la (ou les) bonne(s) réponse(s).
| ||
| ||
|
L'énergie libérée lors d'une combustion dépend de l'énergie de réaction. Cette dernière dépend des liaisons créées ou rompues lors de la transformation chimique. Selon l'espèce chimique de départ, l'énergie de réaction sera différente et donc l'énergie libérée également. L'énergie libérée est fonction de la quantité de matière de combustible : elle est donc proportionnelle à la masse de combustible.
Si 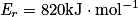 , et n = 2,0 mol de méthane, alors
, et n = 2,0 mol de méthane, alors 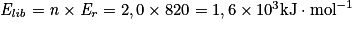 . Soit en tenant compte des unités :
. Soit en tenant compte des unités : 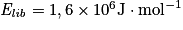 .
.
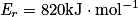 , et n = 2,0 mol de méthane, alors
, et n = 2,0 mol de méthane, alors 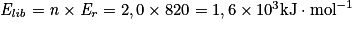 . Soit en tenant compte des unités :
. Soit en tenant compte des unités : 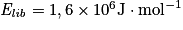 .
.
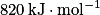 , alors l'énergie libérée par la combustion d'une quantité de matière n = 2,0 mol de méthane est
, alors l'énergie libérée par la combustion d'une quantité de matière n = 2,0 mol de méthane est 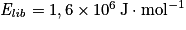 .
.
