Certains noyaux sont naturellement radioactifs. C'est Henri Becquerel qui en 1896 découvre la radioactivité. En rangeant sa plaque photographique près de sels d'uranium qu'il était en train d'étudier, il découvrit que la plaque photographique avait reçu une impression sans même avoir été exposée à la lumière.
I. Quelles sont les sources de radioactivité ?
• Depuis toujours, l'homme vit dans un environnement radioactif qui peut avoir plusieurs causes : les rayons cosmiques, les éléments radioactifs eux-mêmes présents dans le sol et des éléments radioactifs présents dans son corps. De plus, depuis la seconde guerre mondiale, l'homme a créé des sources radioactives artificielles : médecine, industrie nucléaire…
• Parmi les éléments qui sont responsables de la radioactivité naturelle, on peut citer :
- Le carbone 14 qui s'incorpore à tous les êtres vivants et qui est formé en haute atmosphère ;
- Le potassium 40, le thorium 232 et l'uranium 238 que l'on trouve dans le sol depuis la création de la Terre ;
- Les éléments issus de la désintégration du thorium et de l'uranium, par exemple le radon 222 qui est un gaz invisible, inodore et insipide qui s'échappe du sol. Ce dernier a tendance à se concentrer dans les volumes peu aérés. L'homme le respire. Le radon participe pour 40 % à la radioactivité naturelle qui entoure l'homme.
• Comme certaines eaux minérales ont circulé dans le sol, elles peuvent contenir naturellement de l'uranium, du thorium et du potassium. Elles ont parfois une radioactivité plus élevée que celle de l'eau potable.
• Plusieurs objets qui nous entourent sont radioactifs. Les sacs d'engrais potassés sont très radioactifs à cause de la présence de potassium 40. Les détecteurs de fumée contiennent de l'américium 241 qui est également radioactif. Les cadrans de montre ancienne étaient rendus luminescents grâce au radium qui est très radioactif.
• Ainsi la part des différentes sources de radioactivité auxquelles un individu est exposé en France s'établit de cette manière :
- Radon émanant des roches granitiques : 37 %
- Examens et traitements médicaux : 31 %
- Rayonnement terrestre : 13 %
- Rayonnement cosmique : 11 %
- Rayonnement du corps humain : 7 %
- Activités industrielles : 1 % dont 0,06 % pour l'énergie électronucléaire.
II. Que deviennent les noyaux instables ?
• Les noyaux en dehors de la vallée de stabilité sont instables : on dit qu'ils sont radioactifs et vont donc se désintégrer, c'est-à-dire modifier leur noyau pour devenir stables.
• La désintégration radioactive est un phénomène aléatoire, spontané, inéluctable, et indépendant des paramètres extérieurs : on ne peut ni le stopper ni l'accélérer, seulement isoler les noyaux radioactifs jusqu'à ce qu'ils soient tous désintégrés…
• Sur l'illustration ci-dessous, chaque cercle coloré représente un noyau radioactif encore présent dans un échantillon radioactif.
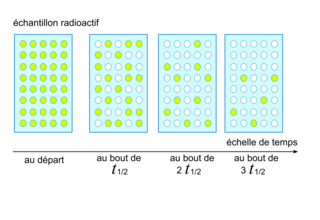 |
• On peut noter que le nombre de noyaux restants est divisé par deux à chaque période radioactive notée t1/2 (temps de demi-vie) sur le schéma.Exercice n°2
III. Comment sont caractérisés les éléments radioactifs ?
• Chaque élément radioactif est caractérisé par sa courbe de décroissance radioactive, qui représente l'évolution du nombre de noyaux restant dans l'échantillon (N) en fonction du temps (t). Cette courbe a toujours la même allure, c'est une courbe exponentielle décroissante :
Courbe de décroissance radioactive
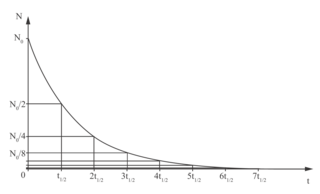 |
| Nombre de noyaux restants | N0 | 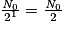 | 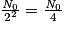 | 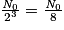 | 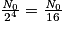 | 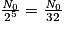 | 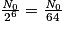 | 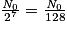 | … |
| Durée | 0 | t1/2 | 2 × t1/2 | 3 × t1/2 | 4 × t1/2 | 5 × t1/2 | 6 × t1/2 | 7 × t1/2 | |
• L'activité de l'échantillon représente le nombre de désintégrations par seconde. Elle est proportionnelle au nombre de noyaux radioactifs dans l'échantillon. De ce fait, la courbe donnant l'activité d'un échantillon au cours du temps sera de même nature que celle du nombre de noyaux N au cours du temps. Son unité est le Becquerel (Bq) : 1 Bq correspond à une désintégration par seconde.
• Le temps de demi-vie t1/2, parfois appelé période radioactive, est la durée nécessaire pour que la moitié des noyaux présents initialement se soient désintégrés. On constate sur la courbe ci-dessus qu'au bout de 2t1/2 le nombre de noyaux a encore diminué de moitié, et ainsi de suite.
• Le temps de demi-vie ne dépend que de la nature du noyau. Selon les atomes radioactifs concernés, cette période est très variable : quelques secondes, quelques heures, plusieurs jours, des centaines d'années… ou des milliards d'années. Ainsi le temps de demi-vie du polonium 212 est de 0,3 μs (microseconde) alors que celui du thorium 232 est de 14 milliards d'années !
• Chaque noyau est caractérisé par le temps de demi-vie.
IV. Comment détermine-t-on le temps de demi-vie ou période radioactive ?
• Prenons la courbe de décroissance radioactive du césium 137 :
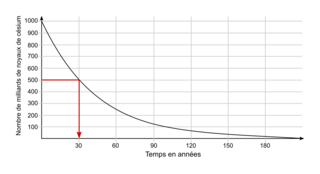 |
• Pour trouver son temps de demi-vie, il faut déterminer son nombre initial de noyaux, ici N0 = 1 000 milliards. L'abscisse du point de la courbe qui a pour ordonnée 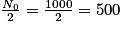 milliards de noyaux. On trouve t1/2 = 30 ans.
milliards de noyaux. On trouve t1/2 = 30 ans.
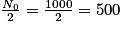 milliards de noyaux. On trouve t1/2 = 30 ans.
milliards de noyaux. On trouve t1/2 = 30 ans.• Avec la même logique, on peut remplir le tableau suivant :
Exercice n°3
| Nombre de noyaux restants (en milliards) | N0 = 1 000 | 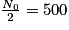 | 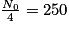 | 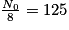 | 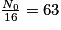 |
| Durée (en ans) | 0 | t1/2 = 30 | 2 × t1/2 = 60 | 3 × t1/2 = 90 | 4 × t1/2 = 120 |
V. Comment procède-t-on pour la datation ?
• La découverte de la radioactivité naturelle a marqué un considérable progrès pour l'étude archéologique. On sait, à présent, que le matériel constituant les sites archéologiques contient des éléments radioactifs dont la teneur varie avec le temps et qu'il devient donc possible de dater les événements en déterminant l'âge des roches, des objets, etc.
• Mais chaque isotope radioactif ne pourra être utilisé que pour dater des événements appartenant à une période définie, en fonction de sa demi-vie et de sa concentration initiale.
• Pour dater un événement, on mesure la radioactivité qui se dégage d'une roche ou d'un os ayant appartenu à un être vivant. On utilise des méthodes différentes selon l'âge géologique de cet objet :
- utilisation de l'uranium 238 pour des événements datant autour de 4,5 milliards d'années, comme la Terre, ou une météorite… car son temps de demi-vie est de 4,5 milliards d'années ;
- utilisation du potassium 40 pour certaines datations au-delà de 200 000 ans, car son temps de demi-vie est de 1,3 milliard d'années. Il est utilisé pour déterminer l'âge de formation des roches qui peuvent dater de l'âge de la Terre ;
- utilisation du carbone 14 pour des datations jusqu'à 50 000 ans, car son temps de demi-vie est de 5 600 ans, pour les êtres vivants.
• Prenons, par exemple, la datation au carbone 14 d'une momie égyptienne. De son vivant, cet individu absorbe du carbone quotidiennement. Son corps renferme du carbone 12 et du carbone 14 dans des proportions constantes. Le taux de carbone 14 dans la matière vivante est donc identique au taux atmosphérique. Quand il meurt, il n'intègre plus de carbone 14. Les noyaux de carbone 14, qui sont instables, disparaissent progressivement selon la courbe de décroissance radioactive vue précédemment (ils diminuent de moitié tous les 5 600 ans). La mesure de la radioactivité d'un échantillon du corps de la momie contenant du carbone permet de connaître le nombre de noyaux de carbone 14. On le compare au nombre de noyaux de carbone 14 contenus dans un échantillon actuel de même masse et on déduit son âge à 200 ans près. Il faut calibrer à nouveau les mesures actuelles, car les essais nucléaires dans l'atmosphère ont produit beaucoup de carbone.
• Le potassium 40 est radioactif et se désintègre en argon 40 qui est un gaz qui restera piégé dans la roche contenant le potassium. En mesurant un échantillon de la roche, on peut mesurer la quantité de potassium 40 et d'argon 40 et en déduire l'âge de formation de la roche. La même méthode existe pour l'uranium 238 qui se transforme en plomb 206.Exercice n°4
VI. Quels sont les effets biologiques de la radioactivité ?
• Un échantillon radioactif émet des radiations, c'est-à-dire des noyaux d'hélium ou des électrons ou positons à grande vitesse. Il s'organise dans deux directions : son pouvoir de pénétration et son pouvoir d'ionisation. Les noyaux d'hélium étant très gros peuvent provoquer de nombreux dégâts, mais on peut facilement les arrêter. Les électrons ou les positons pénètrent plus profondément dans la matière. Selon l'énergie cinétique que les noyaux possèdent, le rayonnement pénètre donc plus ou moins la matière. Le rayonnement est capable « d'arracher » des électrons aux atomes pour former des ions ou des radicaux libres, surtout sur les molécules d'eau.
• Si les expositions sont légères, les lésions créées pourront être réparées. Par contre si l'exposition est plus importante, la réparation n'est plus possible. Il y aura deux types de conséquences :
- des effets sur les globules rouges ou sur les muqueuses de la peau et des intestins ;
- des modifications dans le patrimoine génétique.
À retenir
Des éléments naturellement radioactifs nous entourent : le carbone 14, le radon 222, le potassium 40. On en trouve même dans les eaux minérales ou les détecteurs de fumée. De plus, les examens et traitements médicaux, le rayonnement cosmique ou l'activité industrielle exposent les individus aux sources radioactives.Tous les noyaux radioactifs sont instables et se désintègrent. Ce phénomène est aléatoire, spontané, inéluctable et indépendant des paramètres extérieurs.
Au bout de chaque période radioactive ou temps de demi-vie notée t1/2, le nombre des noyaux radioactifs restants est divisé par deux. Chaque temps de demi-vie est caractéristique d'un élément.
L'activité est le nombre de désintégrations par seconde. Son unité est le Bq.
Pour dater des roches, des matières préhistoriques, etc., on relève la radioactivité actuelle d'éléments radioactifs comme le carbone 14 ou le potassium 40.
L'exposition à des échantillons radioactifs peut entraîner des lésions irréversibles comme des modifications dans le patrimoine génétique.
Exercice n°1
En France, la radioactivité naturelle est essentiellement due :
Cochez la bonne réponse.
| ||
| ||
|
En France, la part la plus grande de radioactivité est attribuée au radon, qui émane des roches granitiques.
Exercice n°2
Quelles sont les propriétés des désintégrations radioactives ?
Cochez la bonne réponse.
| ||
| ||
|
La désintégration radioactive est un phénomène qui est aléatoire et spontané. On peut ajouter qu'il est inéluctable (c'est-à-dire qu'on ne peut l'empêcher) et indépendant de tous les paramètres extérieurs.
Exercice n°3
Au bout de 6 périodes radioactives, le nombre de noyaux a été divisé par :
Cochez la bonne réponse.
| ||
| ||
|
Au bout de 6 périodes radioactives, le nombre de noyaux est 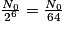 , il a donc été divisé par 64.
, il a donc été divisé par 64.
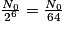 , il a donc été divisé par 64.
, il a donc été divisé par 64.Exercice n°4
Pour dater des roches, on utilise :
Cochez la bonne réponse.
| ||
| ||
|
Comme l'utilisation du carbone 14 nécessite un organisme vivant, on utilise pour dater les roches le potassium 40 ou l'uranium 238.
Exercice n°5
En cas d'exposition légère à une source radioactive :
Cochez la bonne réponse.
| ||
| ||
|
En cas d'exposition légère et non répétée, les lésions créées sont réparables. Dans le cas contraire, l'exposition est très dangereuse.


