Tous les atomes se sont formés après le Big Bang. Au départ, ce ne sont qu'un petit nombre de particules élémentaires qui se sont organisées et sont devenues l'immense diversité de la matière que l'on connaît. Comment ont été créés les éléments qui composent l'Univers ? D'où viennent les différents éléments chimiques du tableau périodique ?
I. Qu'est-ce qu'un élément chimique ? Rappels
• L'atome est formé d'un noyau et d'électrons qui tournent autour du noyau. Le noyau est chargé positivement, les électrons négativement. L'ensemble des électrons constitue le nuage électronique. L'atome est électriquement neutre.
• Le noyau est assimilable à une boule dont le diamètre est de 10 000 à 100 000 fois plus petit que le diamètre de l'atome, mais il renferme la quasi-totalité de la masse de l'atome (plus de 99,9 %). Le noyau contient des protons et des neutrons qui ont des masses voisines de 1,67.10 −27 kg. Le proton porte une charge positive de valeur 1,6.10 −19 C. Le neutron ne porte pas de charge électrique.
• Les protons et les neutrons, comme constituants du noyau, sont appelés les nucléons. Le numéro atomique Z correspond au nombre de protons contenus dans le noyau. Le nombre de masse A correspond au nombre de nucléons contenus dans le noyau. Pour calculer le nombre de neutrons contenus dans le noyau, la formule est donc N = A – Z.
• Un nucléide regroupe un ensemble d'atomes possédant des noyaux identiques. Il est caractérisé par les deux nombres A et Z. On le note 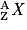 où X est le symbole de l'atome correspondant. Un élément chimique est constitué par des nucléides de même numéro atomique Z. Ils sont répertoriés dans le tableau périodique des éléments.
où X est le symbole de l'atome correspondant. Un élément chimique est constitué par des nucléides de même numéro atomique Z. Ils sont répertoriés dans le tableau périodique des éléments.
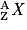 où X est le symbole de l'atome correspondant. Un élément chimique est constitué par des nucléides de même numéro atomique Z. Ils sont répertoriés dans le tableau périodique des éléments.
où X est le symbole de l'atome correspondant. Un élément chimique est constitué par des nucléides de même numéro atomique Z. Ils sont répertoriés dans le tableau périodique des éléments.• On appelle isotopes des nucléides qui ont même Z, mais qui diffèrent par leurs valeurs de A et qui n'ont donc pas le même nombre de neutrons. Ils peuvent avoir des propriétés très différentes. La stabilité dépend du nombre de nucléons dans le noyau. Par exemple, les isotopes du carbone sont : 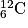 ;
; 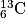 ;
; 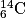 .
.
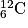 ;
; 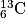 ;
; 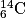 .
.II. Comment nomme-t-on un élément chimique ?
• À l'origine, le nom de l'élément chimique était donné par son découvreur. L'accent était souvent mis sur leur nationalité ou leurs particularités. On peut citer le « polonium » découvert par Marie Curie qui était d'origine polonaise, ou le « germanium » qui fut baptisé d'après l'Allemand Winkler.
• Depuis les années 1950, avec la course effrénée entre laboratoires, le découvreur est parfois difficile à identifier. Depuis 1997, c'est l'Union internationale de chimie pure et appliquée qui choisit les noms et rend souvent hommage à de grands physiciens comme l'« einsteinium » ou le « fermium ».
III. Quelle est l'origine des éléments de notre Univers ?
• D'après la théorie du « Big Bang », tout aurait commencé il y a environ quinze milliards d'années par un grand « boum ». Apparaissent très rapidement les photons avec quelques protons, quelques neutrons et quelques électrons. Un peu plus d'une minute plus tard ce sont les noyaux d'hydrogène 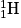 , puis de deutérium
, puis de deutérium 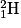 , d'hélium
, d'hélium 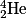 et de lithium
et de lithium 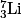 qui se forment. Ceux-ci, en récupérant des électrons, forment ensuite les premiers atomes.
qui se forment. Ceux-ci, en récupérant des électrons, forment ensuite les premiers atomes.
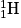 , puis de deutérium
, puis de deutérium 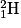 , d'hélium
, d'hélium 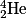 et de lithium
et de lithium 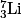 qui se forment. Ceux-ci, en récupérant des électrons, forment ensuite les premiers atomes.
qui se forment. Ceux-ci, en récupérant des électrons, forment ensuite les premiers atomes.• C'est ensuite au tour des galaxies, constituées de milliards d'étoiles, d'apparaître. On ne sait pas encore précisément comment elles se sont créées, mais on sait que les étoiles qui les constituent naissent de réactions de fusion et de fission nucléaire.
• Grâce aux températures extrêmement élevées qui règnent dans les cœurs des étoiles, des réactions de fusion nucléaire ont transformé les noyaux légers en noyaux plus lourds, fabriquant ainsi de nouveaux éléments. La réaction de fusion de l'hélium (avec un autre noyau d'hélium ou avec un élément différent) donne du carbone, de l'oxygène et de l'azote. Si l'étoile est suffisamment grosse, elle pourra donner aussi naissance au néon, au magnésium, au silicium et au soufre.
• De plus, plus les noyaux à produire sont lourds et plus la température et la pression au cœur de l'étoile doivent être élevées. L'élément fer est ainsi l'élément le plus lourd qui pourra être obtenu à ce stade. Les étoiles consomment leur hydrogène pour produire des éléments plus lourds : elles s'appauvrissent petit à petit en hydrogène. Puis, elles brûlent tous leurs autres constituants : d'abord l'hélium, ensuite le carbone, l'oxygène, le néon, le magnésium, le silicium jusqu'à produire du fer qui est l'élément le plus stable de l'Univers. L'étoile meurt et explose. C'est dans cette phase explosive qu'il y a d'autres réactions de fusion pour former des noyaux plus lourds que le fer, comme le plomb, l'uranium, mais aussi l'or et le platine…
• Dans l'espace interstellaire, des fissions nucléaires se produisent : elles sont dues aux chocs que subissent des noyaux de carbone, d'azote ou d'oxygène évacués à grande vitesse lors d'explosions d'étoiles ou sous l'effet de forts vents stellaires, formant ainsi des noyaux légers.
IV. Comment se sont formés les éléments chimiques ?
Les réactions de fusion
• L'Univers a créé des protons, des neutrons et d'autres particules. Les premiers noyaux d'hydrogène 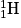 ont fusionné pour former le deutérium
ont fusionné pour former le deutérium 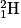 et un positon noté
et un positon noté 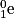 comme suit :
comme suit :
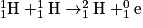
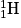 ont fusionné pour former le deutérium
ont fusionné pour former le deutérium 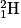 et un positon noté
et un positon noté 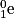 comme suit :
comme suit :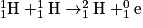
• D'autres réactions de fusion donnent des atomes de tritium 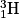 et d'hélium
et d'hélium 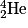 et une particule, le neutron, noté
et une particule, le neutron, noté 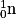 .
.
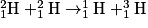
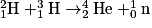
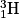 et d'hélium
et d'hélium 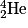 et une particule, le neutron, noté
et une particule, le neutron, noté 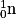 .
.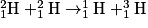
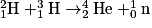
• On remarque que toutes les réactions de fusion conduisent à partir de noyaux plus légers (constitués de moins de particules) à des noyaux plus lourds. Ainsi on peut donner la fusion d'un noyau d'hélium 4 et d'un noyau de lithium 7 pour former un noyau de bore 11 selon :
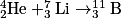
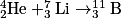
Réaction de fusion nucléaire
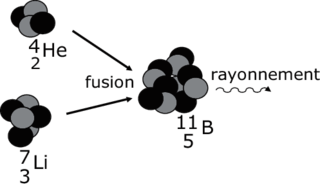 |
• Ces réactions sont très exoénergétiques (bombe H) : elles produisent une grande quantité d'énergie. Elles ne peuvent s'effectuer qu'à très haute température (108 K). Elles sont souvent appelées « réactions thermonucléaires ».
Les réactions de fission
• Lors d'une réaction de fission nucléaire, un noyau lourd se fragmente, généralement sous l'impact d'un neutron, pour former deux noyaux plus légers. Cette réaction libère de nouveaux neutrons qui peuvent réagir avec d'autres noyaux pour donner une réaction en chaîne. Par exemple, la fission d'un noyau de bore 11 peut former un noyau d'hélium 4 et un noyau de lithium 7 :
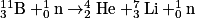
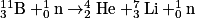
Réaction de fission nucléaire
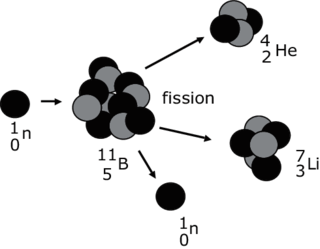 |
• Dans les centrales nucléaires, on utilise la fission d'un noyau d'uranium 235 :
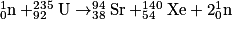
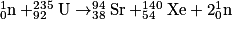
V. Les éléments chimiques sont-ils tous stables ?
• Si un élément est instable, il peut être sujet à des réactions nucléaires. L'étude des différents éléments montre qu'ils sont stables dans les conditions suivantes :
- Si Z < 20, alors le nombre de neutrons est à peu près égal à celui des protons.
- Si Z > 20, le nombre de neutrons doit être supérieur au nombre de protons.
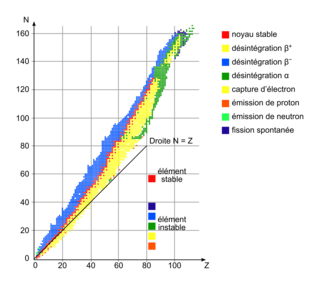
• L'élément le plus stable est le fer : 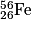 . La vallée de stabilité (en rouge sur le diagramme N – Z ci-dessous) ne se poursuit pas au-delà du bismuth :
. La vallée de stabilité (en rouge sur le diagramme N – Z ci-dessous) ne se poursuit pas au-delà du bismuth : 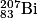 .
.
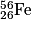 . La vallée de stabilité (en rouge sur le diagramme N – Z ci-dessous) ne se poursuit pas au-delà du bismuth :
. La vallée de stabilité (en rouge sur le diagramme N – Z ci-dessous) ne se poursuit pas au-delà du bismuth : 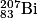 .
. |
• L'homme a cherché à créer de nouveaux éléments. Actuellement, le dernier noyau fabriqué par un groupe de chercheurs américains et russes est constitué de 118 protons. Mais sa durée de vie est de moins d'une milliseconde.
VI. Quels sont les éléments chimiques les plus abondants ?
Le tableau suivant donne le pourcentage en nombre d'atomes des éléments présents :
| Élément | Univers | Soleil | Globe terrestre | Eau de mer | Atmosphère terrestre | Corps humain | Végétaux |
| H | 90 | 94 | 0,2 | 66 | 0 | 61 | 47,9 |
| He | 9 | 6 | 0 | 0 | 0 | 0 | 0 |
| C | 0,06 | 0,04 | 0,02 | 0,0014 | 0,0015 | 12,8 | 27,9 |
| N | 0,01 | 0,007 | 0,004 | 0 | 78 | 1,4 | 1,1 |
| O | 0,1 | 0,06 | 48,8 | 33 | 21 | 24,1 | 21,9 |
| Ne | 0,012 | 0,004 | 0 | 0 | 0 | 0 | 0 |
| Na | 0 | 0 | 0 | 0,28 | 0 | 0,04 | 0 |
| Mg | 0,005 | 0,004 | 16,5 | 0,033 | 0 | 0,008 | 0,13 |
| Al | 0 | 0 | 1,6 | 0 | 0 | 0 | 0 |
| Si | 0,005 | 0,005 | 13,8 | 0 | 0 | 0 | 0 |
| P | 0 | 0 | 0 | 0 | 0 | 0,25 | 0,1 |
| S | 0,002 | 0,001 | 3,7 | 0,017 | 0 | 0,05 | 0,1 |
| Ca | 0 | 0 | 0 | 0,006 | 0 | 0,24 | 0,25 |
| Fe | 0,004 | 0,003 | 14,3 | 0 | 0 | 0 | 0 |
• L'Univers est constitué d'atomes d'hydrogène et d'hélium. La Terre est constituée d'atomes d'oxygène, d'hydrogène, de fer, de silicium et de magnésium. Le vivant comporte surtout des atomes de carbone, d'hydrogène, d'oxygène.
Répartition des éléments sur le globe terrestre
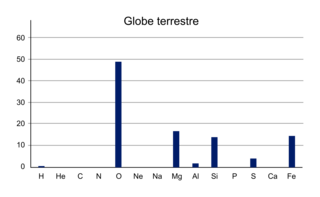 |
Répartition des éléments dans le corps humain
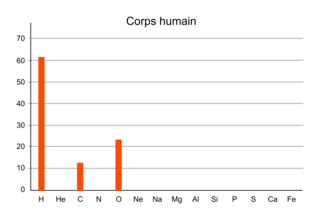 |
À retenir
Les atomes sont constitués de protons et de neutrons se trouvant dans le noyau et d'électrons qui tournent autour. Ils sont répertoriés selon leur numéro atomique dans le tableau périodique des éléments par numéro atomique croissant.Tous les atomes ont été créés après le Big Bang à partir de l'élément hydrogène. Ce sont les étoiles ou leurs explosions qui favorisent l'apparition de nouveaux éléments par réaction de fusion ou de fission.
Les éléments ne sont pas tous stables : seule une centaine le sont.
L'Univers, la Terre et les êtres vivants ne sont pas constitués des mêmes éléments. L'Univers est surtout formé d'hydrogène et d'hélium, la Terre d'oxygène, d'hydrogène, de fer, de silicium et de magnésium et les êtres vivants de carbone, d'hydrogène, d'oxygène et d'azote.
Les réactions de fusion conduisent à des éléments plus lourds alors que les réactions de fission conduisent à des éléments plus légers.
Exercice n°1
Que contient le noyau d'un élément chimique ?
Cochez la bonne réponse.
| ||
| ||
|
Un atome est constitué d'un noyau et d'électrons qui tournent autour de celui-ci. Le noyau est lui-même constitué de protons et de neutrons. Un proton est chargé positivement et un neutron n'est pas chargé.
Exercice n°2
D'après la théorie du Big Bang, quelles sont les premières particules apparues ?
Cochez la bonne réponse.
| ||
| ||
|
Aux premiers instants après le Big Bang sont apparues les premières particules que sont les protons, les neutrons et quelques électrons. Ce n'est qu'ensuite que des noyaux plus complexes comme ceux d'hydrogène, de deutérium, d'hélium ou de lithium se sont formés.
Exercice n°3
À partir des noyaux légers comme l'hydrogène, ou l'hélium, comment les étoiles fabriquent-elles des noyaux plus lourds ?
Cochez la bonne réponse.
| ||
| ||
|
Ce sont les réactions de fusion nucléaire qui permettent à partir de noyaux légers d'obtenir des noyaux plus lourds.
Exercice n°4
Quelle proposition est vraie ?
Cochez la bonne réponse.
| ||
| ||
|
La vallée de stabilité dans le diagramme N – Z montre que le bismuth 83 est l'élément le plus lourd des éléments stables. La courbe d'Aston montre également que le fer 56 est le plus stable.
Exercice n°5
De quoi est constitué le vivant ?
Cochez la bonne réponse.
| ||
| ||
|
Le vivant est surtout constitué d'atomes de carbone, d'hydrogène et d'oxygène. L'Univers comme les étoiles est constitué d'hydrogène et d'hélium.
Exercice n°6
Les réactions de fission nucléaire permettent de :
Cochez la bonne réponse.
| ||
| ||
|
La fission nucléaire fragmente les noyaux atomiques créant ainsi des noyaux plus légers.


