Modélisation des transformations physiques de la matière et transfert d'énergie
La matière se trouve sous trois états : liquide, solide, gazeux. L'état solide est condensé et ordonné. Plus la température augmente et plus les états deviennent désordonnés. Ainsi le liquide est un état condensé et désordonné alors que le gaz est un état dispersé et désordonné. Les changements d'état peuvent se réaliser entre ses différents états de la matière. Selon que le changement se fasse vers un état plus désordonné ou vers un état plus ordonné, le transfert thermique est cédé ou reçu par l'espèce considérée.
I. La transformation physique
• Une transformation physique est réalisée à chaque fois qu'une espèce passe d'un état physique (solide, liquide, gazeux) à un autre. Comme le nombre et la nature des espèces chimiques ne varient pas, la masse reste constante.
• Chaque changement d'état porte un nom particulier.
• Exemples :
- un glaçon qui fond dans un verre de limonade est une transformation physique : la glace passe de l'état solide à l'état liquide. C'est une fusion ;
- la vapeur d'eau qui se dépose sur un miroir est une liquéfaction ;
- lorsque l'eau de cuisson des pâtes « disparaît » de la casserole, il s'agit d'une vaporisation ;
- les flaques qui gèlent l'hiver correspondent à une solidification.
• Il ne faut pas confondre la fusion et la dissolution. La fusion correspond au passage de l'état solide à l'état liquide. Le verglas fond au soleil. C'est un changement d'état. Par contre, la dissolution est l'action de dissoudre un soluté. Il ne faut donc pas dire que le sucre fond dans le café, mais le sucre se dissout dans le café. En effet, le sucre ne subit pas un changement d'état (solide à liquide dans le cas de la fusion), mais il se disperse dans le café.
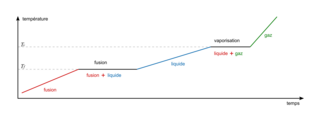
• Lors d'un changement d'état d'un corps pur, la température reste constante : il y a des paliers de température qui sont caractéristiques de la substance. À ces températures particulières (température de fusion et température de vaporisation), les deux états coexistent simultanément. Lors de la fusion, le solide et le liquide coexistent. De même lors de la vaporisation, le liquide et le gaz coexistent. Ainsi si l'on prend un solide et que l'on augmente progressivement la température au cours du temps, on obtiendra le graphique suivant :
Graphique représentant les changements d'état d'un corps pur lors du chauffage d'un solide
 |
• L'écriture d'un changement d'état se note avec l'état physique en indice entre parenthèses. On utilisera un s pour solide, l pour liquide et g pour gaz.
Exemple : l'eau passant de l'état liquide à l'état gazeux aura pour équation de changement d'état :
H2O(l)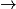 H2O(g).
H2O(g).
Exemple : l'eau passant de l'état liquide à l'état gazeux aura pour équation de changement d'état :
H2O(l)
 H2O(g).
H2O(g).II. Modéliser une transformation physique
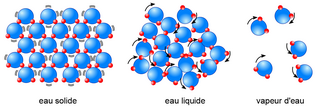
• Un solide constitué d'un seul type d'atomes (ou molécules) est modélisé par des atomes qui sont serrés les uns contre les autres et accrochés ensemble. On dit que l'état solide est compact et ordonné.
• Un liquide constitué d'un seul type d'atomes (ou molécules) est modélisé par des atomes qui sont tassés, mais ils peuvent glisser les uns sur les autres, car ils ne sont pas attachés. On dit que l'état liquide est compact et désordonné.
• Un gaz constitué d'un seul type d'atomes (ou molécules) est modélisé par un ensemble d'atomes peu nombreux, libres, en mouvement rapide et désordonné. On dit que l'état gazeux est dispersé et très désordonné. (Les atomes ou molécules sont suffisamment dispersés pour que leur fréquence de chocs soit de l'ordre de 10 milliards par seconde.)
Schéma modélisant les états solide, liquide et gazeux
 |
• On remarque ainsi avec les différentes modélisations que l'augmentation de température entraîne une augmentation de l'agitation des atomes (ou des molécules) et inversement.
III. Le transfert thermique
• Le transfert thermique Q est l'énergie échangée sous forme de chaleur par l'espèce qui subit le changement d'état. Comme le transfert thermique est une énergie, son unité est le joule (J).
• Par convention, on choisit un transfert thermique Q positif (Q > 0) si l'espèce reçoit de la chaleur. Et à l'inverse, le transfert thermique Q sera négatif (Q < 0) si l'espèce cède de la chaleur.
IV. Les changements d'état endothermiques et exothermiques
• Les changements d'état nécessitant un apport d'énergie donc un transfert thermique positif (Q > 0) sont dits endothermiques. Les changements d'état cédant de l'énergie donc ayant un transfert thermique négatif (Q < 0) sont dits exothermiques.
Exemple : la fusion de la glace et la vaporisation de l'eau liquide nécessitent un apport d'énergie de l'extérieur.
Exemple : la fusion de la glace et la vaporisation de l'eau liquide nécessitent un apport d'énergie de l'extérieur.
• Lors d'une fusion, d'une vaporisation ou d'une sublimation, la transformation est endothermique, le milieu extérieur se refroidit.
• Lors d'une solidification, d'une liquéfaction ou d'une condensation, la transformation est exothermique, le milieu extérieur se réchauffe.
V. Énergie massique de changement d'état
• Lors d'un changement d'état, l'énergie liée au changement d'état est appelée énergie massique de changement d'état et se note L. Chaque énergie massique de changement d'état est caractéristique de l'espèce considérée. Elle correspond à la quantité d'énergie qu'il faut fournir pour qu'un kilogramme de l'espèce considérée change d'état. Elle est appelée chaleur latente de changement d'état. Elle s'exprime en joule par kilogramme (J  kg-1).
kg-1).
 kg-1).
kg-1).• Pour une même espèce, les chaleurs latentes de changement d'état opposé sont égales en valeur absolue, mais sont de signe contraire, ainsi on a : Lfusion = −Lsolidification, Lvaporisation = −Lliquéfaction et Lsublimation = −Lcondensation.
• Les chaleurs latentes de fusion, de vaporisation et de sublimation sont positives : Lfusion > 0, Lvaporisation > 0 et Lsublimation > 0. Les chaleurs latentes de solidification, de liquéfaction et de condensation sont négatives : Lsolidification < 0, Lliquéfaction > 0 et Lcondensation > 0.
• L'énergie Q transférée lors du changement d'état d'une masse m d'une espèce chimique est donnée par :
Q = m × L,
où Q est le transfert thermique en joules (J),
m est la masse de l'espèce en kilogrammes (kg),
L est la chaleur latente de changement d'état en joules par kilogramme (J kg-1).
kg-1).
Q = m × L,
où Q est le transfert thermique en joules (J),
m est la masse de l'espèce en kilogrammes (kg),
L est la chaleur latente de changement d'état en joules par kilogramme (J
 kg-1).
kg-1).• En pratique, la détermination de l'énergie Q lors d'un changement d'état peut s'effectuer dans un calorimètre. Celui-ci a la propriété de n'échanger quasiment aucune énergie avec l'extérieur. Ainsi la somme de tous les échanges de température à l'intérieur d'un calorimètre est nulle. C'est la méthode des mélanges.
À retenir :
Connaître l'écriture symbolique d'un changement d'état. Connaître des exemples de changement d'état physique de la vie courante.
Savoir établir l'écriture d'une équation pour un changement d'état.
Savoir distinguer fusion et dissolution.
Savoir modéliser un changement d'état à l'échelle microscopique.
Savoir identifier le sens du transfert thermique lors d'un changement d'état et le relier au terme exothermique ou endothermique.
Savoir calculer l'énergie de changement d'état et connaître ses applications. Savoir exploiter la relation entre l'énergie transférée lors d'un changement d'état et l'énergie massique de changement d'état de l'espèce.
Connaître l'écriture symbolique d'un changement d'état. Connaître des exemples de changement d'état physique de la vie courante.
Savoir établir l'écriture d'une équation pour un changement d'état.
Savoir distinguer fusion et dissolution.
Savoir modéliser un changement d'état à l'échelle microscopique.
Savoir identifier le sens du transfert thermique lors d'un changement d'état et le relier au terme exothermique ou endothermique.
Savoir calculer l'énergie de changement d'état et connaître ses applications. Savoir exploiter la relation entre l'énergie transférée lors d'un changement d'état et l'énergie massique de changement d'état de l'espèce.
Exercice n°1
Quelle proposition sur les changements d'état est juste ?
Cochez la bonne réponse.
| ||
| ||
|
La fusion est le passage de l'état solide à l'état liquide alors que la vaporisation est le passage de l'état liquide à l'état gazeux : ce ne sont pas des changements d'état inverse. La solidification est le passage de l'état liquide à l'état solide et la liquéfaction est le passage de l'état gazeux à l'état liquide : ce ne sont pas des changements d'état inverse, ils n'ont pas la même température de changement d'état. La sublimation est le passage de l'état solide à l'état gazeux et la condensation de l'état gazeux à l'état solide : ce sont bien des changements d'état inverse.
Exercice n°2
Quel adjectif qualifie le mieux les atomes (ou molécules) à l'état liquide ?
Cochez la bonne réponse.
| ||
| ||
|
Les atomes de l'état liquide sont désordonnés et compacts. Seul l'état gazeux présente des atomes (ou molécules) dispersés et seul l'état solide présente des atomes (ou des molécules) ordonnés.
Exercice n°3
Quelle proposition sur le transfert thermique est vraie ?
Cochez la bonne réponse.
| ||
| ||
|
Le transfert thermique est l'énergie transférée sous forme de chaleur. Lorsqu'il est positif, le système reçoit de l'énergie, alors que lorsqu'il est négatif, le système en cède.
Exercice n°4
Quelle proposition sur le changement d'état endothermique est vraie ?
Cochez la bonne réponse.
| ||
| ||
|
Un changement d'état endothermique nécessite un apport d'énergie : le système reçoit de la chaleur. Par conséquent, le transfert thermique est positif. Comme le milieu extérieur donne de l'énergie au système, il se refroidit : de la chaleur passe du milieu extérieur au système. La fusion, la vaporisation et la sublimation sont des changements d'état endothermiques. En revanche, la solidification, la liquéfaction et la condensation sont des changements d'état exothermiques.
Exercice n°5
Que vaut l'énergie transférée au milieu extérieur d'un kilogramme de glace (eau) qui fond ? Données : Lsolidification = −334 000 J  kg-1, Lvaporisation = 2 257 000 J
kg-1, Lvaporisation = 2 257 000 J  kg-1.
kg-1.
 kg-1, Lvaporisation = 2 257 000 J
kg-1, Lvaporisation = 2 257 000 J  kg-1.
kg-1. Cochez la bonne réponse.
| ||
| ||
|
Pour calculer l'énergie transférée lors du changement d'état de chaleur latente L, il faut appliquer la relation Q = m × L. Ici, la glace qui fond correspond à une fusion. Or, Lfusion = −Lsolidification = 334 000 J  kg-1. Donc numériquement, Q = 1 × 334 000 = 334 000 J.
kg-1. Donc numériquement, Q = 1 × 334 000 = 334 000 J.
 kg-1. Donc numériquement, Q = 1 × 334 000 = 334 000 J.
kg-1. Donc numériquement, Q = 1 × 334 000 = 334 000 J.
