Énoncé
Jeux et physique-chimie (10 points)
Un enfant trouve, dans la malle d'un grenier, deux jeux datant des années 1970 : un tac-tac, et un coffret-jeux d'initiation à la chimie. Ne connaissant pas le principe du tac-tac, il cherche sur Internet et trouve les informations suivantes : le tac-tac est un jouet qui a connu une mode éphémère au début des années 1970. L'objet est constitué de deux boules de plastique dur reliées par une cordelette d'environ 40 cm de long, au milieu de laquelle un anneau de plastique est fixé par un nœud. En imprimant de légers mouvements à cet anneau, on amène les boules à rebondir l'une contre l'autre, en produisant le bruit qui donne son nom au jeu.
D'après francetvinfo.fr
On s'intéresse dans ce sujet au comportement des boules du tac-tac, puis à un "liquide magique" qu'il est possible de réaliser avec le coffret-jeux d'initiation à la chimie.
D'après francetvinfo.fr
On s'intéresse dans ce sujet au comportement des boules du tac-tac, puis à un "liquide magique" qu'il est possible de réaliser avec le coffret-jeux d'initiation à la chimie.
Partie 1 : étude du tac-tac
Le tac-tac est présenté sur la photographie ci-dessous. Dans ce qui suit, on appelle :- boule 1, la boule située à droite sur la photographie ;
- boule 2, la boule située à gauche sur la photographie.
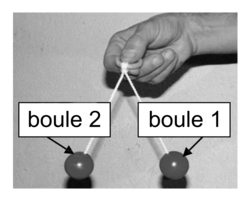 |
A. Étude énergétique de la boule 1
On modélise le jeu par un pendule simple constitué de la boule 1 de masse m = 80 g, suspendue à un fil inextensible de masse négligeable et de longueur L = 20 cm. Le fil est accroché au point I et les mouvements du pendule s'effectuent dans un plan vertical.Le joueur écarte la boule 1 d'un angle αm. Le centre de la boule 1 est ainsi situé au point G. Le joueur lâche la boule 1 sans vitesse initiale.
Le mouvement du pendule est étudié dans le repère (G0 ; x ; z) orienté comme l'indique la figure ci-dessous ; l'axe (G0z) est vertical. On néglige les frottements.
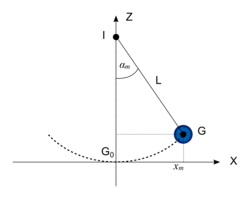 |
Données :
- l'énergie potentielle de pesanteur est choisie nulle au point G0 le plus bas de la trajectoire ;
- la valeur de l'intensité de la pesanteur est g = 9,8 N·kg−1.
A.1. On s'intéresse à la boule 1 lorsqu'elle est à une hauteur z et possède une vitesse v. Rappeler les expressions :
- de son énergie cinétique EC ;
- de son énergie potentielle de pesanteur EPP ;
- de son énergie mécanique Em en fonction de m, g, z et v.
A.2. On modélise expérimentalement la situation en utilisant un montage comprenant un capteur et un pendule simple de mêmes caractéristiques que la partie du tac-tac associée à la boule 1. On peut alors tracer les variations des trois types d'énergie précédentes (en mJ) en fonction de l'abscisse x (en mm) du centre de la boule 1 pour seulement une partie de la trajectoire de la boule 1.
On obtient les courbes suivantes :
On obtient les courbes suivantes :
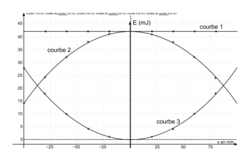 |
Associer, en justifiant la réponse, chaque courbe à l'énergie EC, EPP ou Em dont elle représente les variations.
La boule 1 part d'une certaine hauteur. Arrivée en bas, elle a converti son énergie potentielle en une énergie cinétique qui est alors maximale.
B. Étude du choc entre les deux boules
On lâche sans vitesse initiale la boule 1 du point G. Au point G0, un choc se produit entre la boule 1 et la boule 2 qui initialement est au repos. La boule 2 se met alors en mouvement.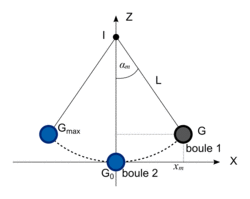 |
On suppose qu'au point G0 et juste avant le choc, la boule 1 possède la vitesse maximale 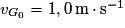 et une énergie mécanique de 42 mJ. Au cours du choc entre les deux boules, il se produit une dissipation d'énergie mécanique Edis = 15 mJ.
et une énergie mécanique de 42 mJ. Au cours du choc entre les deux boules, il se produit une dissipation d'énergie mécanique Edis = 15 mJ.
Juste après le choc, la boule 1 est au repos et la boule 2 se met en mouvement vers la gauche pour atteindre, avant de redescendre, un point extrême Gmax dont on veut déterminer l'altitude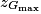 .
.
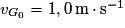 et une énergie mécanique de 42 mJ. Au cours du choc entre les deux boules, il se produit une dissipation d'énergie mécanique Edis = 15 mJ.
et une énergie mécanique de 42 mJ. Au cours du choc entre les deux boules, il se produit une dissipation d'énergie mécanique Edis = 15 mJ.Juste après le choc, la boule 1 est au repos et la boule 2 se met en mouvement vers la gauche pour atteindre, avant de redescendre, un point extrême Gmax dont on veut déterminer l'altitude
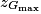 .
.B.1. Calculer l'énergie mécanique 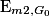 de la boule 2 en G0 juste après le choc.
de la boule 2 en G0 juste après le choc.
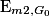 de la boule 2 en G0 juste après le choc.
de la boule 2 en G0 juste après le choc.Faire le bilan des énergies mécaniques avant et après le choc.
B.2. Expliquer pourquoi l'énergie cinétique de la boule 2 au point Gmax est nulle.
Le point Gmax correspond à la hauteur maximale atteinte par la boule 2. Or, au cours du mouvement, il y a conversion de l'énergie potentielle en énergie cinétique, et inversement.
B.3. Exprimer l'énergie mécanique 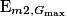 de la boule 2 au point Gmax en fonction de m, g et
de la boule 2 au point Gmax en fonction de m, g et 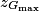 .
.
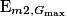 de la boule 2 au point Gmax en fonction de m, g et
de la boule 2 au point Gmax en fonction de m, g et 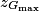 .
.Utiliser la question précédente pour calculer la valeur de l'énergie mécanique de la boule 2 au point Gmax.
B.4. En supposant que l'énergie mécanique de la boule 2 reste constante au cours du mouvement, calculer la valeur de l'altitude 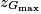 . Conclure.
. Conclure.
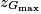 . Conclure.
. Conclure.Si l'énergie mécanique se conserve, la variation d'énergie mécanique entre le point Gmax et le point G0 juste après le choc est nulle.
Partie 2 : étude du "liquide magique"
 |
L'enfant utilise le coffret-jeux d'initiation à la chimie pour réaliser une expérience intitulée "le liquide magique".
L'expérience est à faire en présence d'un adulte.
Le livret fourni dans la boîte indique la marche à suivre :
L'expérience est à faire en présence d'un adulte.
Le livret fourni dans la boîte indique la marche à suivre :
- mets les gants et les lunettes qui sont fournis ;
- dans l'erlenmeyer, verse 150 mL de la solution nommée S ;
- dissous-y 5 g de glucose ;
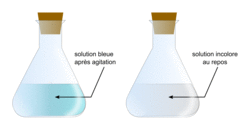
- ajoute 1 g de bleu de méthylène : la solution devient bleue puis progressivement incolore ;
- bouche et agite vigoureusement : la solution redevient immédiatement bleue puis, après agitation, se décolore de nouveau progressivement ;
- agite une nouvelle fois : la solution devient encore bleue puis se redécolore progressivement.
 |
L'objectif de cette partie est d'expliquer l'évolution de la couleur de la solution.
Données :
Données :
- formule brute du glucose : C6H12O6(aq) ;
- masse molaire du glucose : M = 180 g·mol−1 ;
- forme oxydée du bleu de méthylène, notée BM+(aq), seule espèce colorée en solution ;
- forme réduite du bleu de méthylène, notée BMH(aq) ;
- couples oxydant-réducteur mis en jeu :
• BM+(aq)/BMH(aq)
• O2(aq)/H2O(l)
• C6H12O7(aq)/C6H12O6(aq) ;
- volume molaire des gaz dans les conditions de l'expérience Vm = 24,0 L·mol−1 ;
- la composition de l'air est considérée comme connue du candidat.
C. Étude qualitative
C.1. Lorsque l'on agite l'erlenmeyer, une partie du dioxygène de l'air se dissout dans la solution puis réagit en oxydant la forme réduite du bleu de méthylène.
La transformation chimique observée lors de l'agitation peut être modélisée par la réaction (1) dont l'équation est écrite ci-après :
2BMH(aq) + O2(aq) + 2H+(aq) → 2H2O(I) + 2BM+(aq).
Définir une oxydation.
La transformation chimique observée lors de l'agitation peut être modélisée par la réaction (1) dont l'équation est écrite ci-après :
2BMH(aq) + O2(aq) + 2H+(aq) → 2H2O(I) + 2BM+(aq).
Définir une oxydation.
Revenir à la définition d'une réaction d'oxydation.
C.2. Il se produit ensuite une deuxième réaction d'oxydoréduction entre le glucose et le bleu de méthylène sous forme BM+(aq) (réaction (2)).
C.2.1. La demi-équation électronique du couple C6H12O7(aq)/C6H12O6(aq) s'écrit :
C6H12O7(aq) + 2H+(aq) + 2e− = C6H12O6(aq) + H2O(I).
Justifier que le glucose est le réducteur de ce couple.
C6H12O7(aq) + 2H+(aq) + 2e− = C6H12O6(aq) + H2O(I).
Justifier que le glucose est le réducteur de ce couple.
Revenir à la définition d'un réducteur et faire apparaître cette propriété dans la demi-équation d'oxydoréduction ou dans le couple donné.
C.2.2. Écrire la demi-équation électronique du couple BM+(aq)/BMH(aq).
Commencer par équilibrer tous les atomes sauf les H et les O ; puis équilibrer les O, puis les H. Et seulement ensuite, il faut équilibrer les charges.
C.2.3. En déduire l'équation de la réaction (2) modélisant la réduction de la forme oxydée du bleu de méthylène par le glucose.
L'équation de la réaction est une réaction d'oxydoréduction entre le bleu de méthylène BM+(aq) et le glucose C6H12O6(aq). Partir des deux demi-équations électroniques écrites aux questions précédentes.
C.3. À l'aide des modélisations effectuées, expliquer les variations de couleur observées lors de l'expérience avec le « liquide magique ».
Faire le bilan des espèces colorées et les mettre en lien avec les deux réactions qui interviennent lorsque l'on agite (ou non) l'erlenmeyer.
D. Étude quantitative
On considère que, compte tenu des volumes utilisés, une fois bouché hermétiquement, l'erlenmeyer contient un volume d'air Vair = 0,240 L. Le bleu de méthylène introduit réagit dans la réaction (1), puis est régénéré dans la réaction (2).
D.1. Calculer les quantités de matière ni(O2) de dioxygène et ni(C6H12O6) de glucose, contenues initialement dans l'erlenmeyer.
La quantité de dioxygène est à mettre en lien avec le volume de dioxygène contenu dans 0,240 L d'air. La quantité de glucose se déduit des données de l'énoncé.
D.2. Sans rouvrir l'erlenmeyer, l'enfant réalise dans la journée plusieurs séries d'agitations successives. Au bout de quelques heures, l'expérience "le liquide magique" ne fonctionne plus, car la couleur bleue n'apparaît plus.
Justifier que c'est parce que tout le dioxygène disponible a disparu. On attend un raisonnement s'appuyant sur un bilan de matière.
Justifier que c'est parce que tout le dioxygène disponible a disparu. On attend un raisonnement s'appuyant sur un bilan de matière.
Avec un tableau d'avancement ou une équation utilisant les coefficients stœchiométriques, il faut mettre en évidence un réactif limitant.
Corrigé
A.1. L'énergie cinétique est 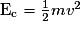 .
.
L'énergie potentielle élastique pour une hauteur z est EPP = mgz.
L'énergie mécanique est la somme de l'énergie cinétique et de l'énergie potentielle, elle vaut donc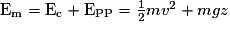 .
.
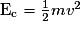 .
.L'énergie potentielle élastique pour une hauteur z est EPP = mgz.
L'énergie mécanique est la somme de l'énergie cinétique et de l'énergie potentielle, elle vaut donc
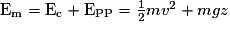 .
.A.2. La boule 1 part d'une certaine hauteur, passe par une hauteur nulle puis remonte : ces variations correspondent à la courbe 3.
Lorsque la boule est en bas, sa vitesse est maximale donc son énergie cinétique aussi. Ceci correspond à la courbe 2.
La somme de l'énergie potentielle et de l'énergie cinétique en chaque point est égale à l'énergie mécanique. De plus, l'énergie mécanique se conserve, donc les frottements sont négligeables.
Lorsque la boule est en bas, sa vitesse est maximale donc son énergie cinétique aussi. Ceci correspond à la courbe 2.
La somme de l'énergie potentielle et de l'énergie cinétique en chaque point est égale à l'énergie mécanique. De plus, l'énergie mécanique se conserve, donc les frottements sont négligeables.
B.1. La boule 1 transmet une partie de son énergie à la boule 2, l'autre partie est dissipée. L'énergie de la boule 2 correspond à l'énergie qu'avait la boule 1 moins les pertes : 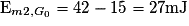 .
.
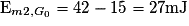 .
.B.2. Le point Gmax est l'altitude maximale que peut atteindre la boule 2. En ce point, son énergie potentielle est maximale et sa vitesse est nulle, donc son énergie cinétique également.
B.3. L'énergie mécanique de la boule 2 au point Gmax est 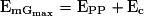 .
.
Or, d'après la question précédente, l'énergie cinétique de la boule 2 au point Gmax est nulle.
Donc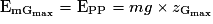 .
.
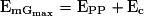 .
.Or, d'après la question précédente, l'énergie cinétique de la boule 2 au point Gmax est nulle.
Donc
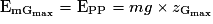 .
.B.4. D'après les questions précédentes, 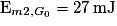 et
et 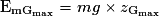 .
.
Comme l'énergie mécanique se conserve,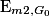 =
= 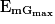 .
.
Donc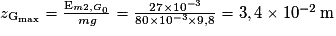 .
.
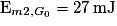 et
et 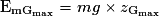 .
.Comme l'énergie mécanique se conserve,
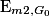 =
= 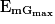 .
.Donc
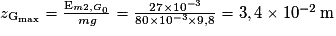 .
.C.1. Une réaction d'oxydation est une réaction au cours de laquelle il y a perte d'électrons.
C.2.1. Un réducteur est une espèce susceptible de perdre des électrons. Dans la demi-équation électronique, le glucose C6H12O6(aq) est bien le réducteur ; de plus, c'est le réducteur du couple proposé.
C.2.2. La demi-équation électronique du couple BM+(aq)/BMH(aq) est :
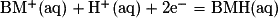
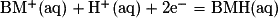
C.2.3. Les deux demi-équations électroniques sont :
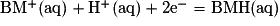
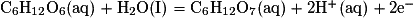
L'équation de la réaction (2) est donc :
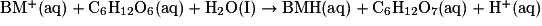
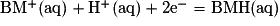
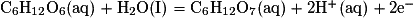
L'équation de la réaction (2) est donc :
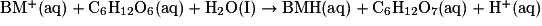
C.3. Lorsque l'on agite l'erlenmeyer, la solution devient bleue, car la réaction (1) se produit et il y a formation d'ions BM+(aq). Or les ions BM+(aq) sont la seule espèce colorée de la solution, et sont bleus. Mais les ions BM+(aq) réagissent ensuite avec le glucose selon la réaction (2) et vont donc disparaître : la solution devient alors incolore.
D.1. Il y a 20 % de dioxygène dans l'air. Donc V(O2) = 0,20 × Vair
Or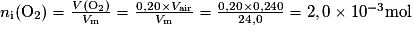 et
et 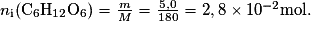
Or
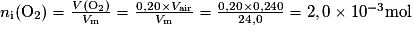 et
et 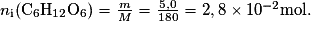
D.2. Avec la réaction (1), pour que les réactifs soient en proportions stœchiométriques, il faut que 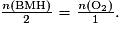
Or la réaction (2) conduit à n(C6H12O6) = n(BMH).
En combinant les deux relations précédentes, on a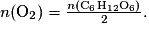
D'après la question précédente,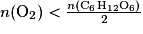 , le dioxygène est le réactif limitant. Il va donc disparaître entièrement de l'erlenmeyer. La réaction (1) ne pourra plus se faire : les ions BM+(aq) responsables de la couleur bleue ne pourront donc plus apparaître.
, le dioxygène est le réactif limitant. Il va donc disparaître entièrement de l'erlenmeyer. La réaction (1) ne pourra plus se faire : les ions BM+(aq) responsables de la couleur bleue ne pourront donc plus apparaître.
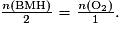
Or la réaction (2) conduit à n(C6H12O6) = n(BMH).
En combinant les deux relations précédentes, on a
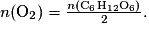
D'après la question précédente,
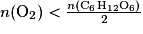 , le dioxygène est le réactif limitant. Il va donc disparaître entièrement de l'erlenmeyer. La réaction (1) ne pourra plus se faire : les ions BM+(aq) responsables de la couleur bleue ne pourront donc plus apparaître.
, le dioxygène est le réactif limitant. Il va donc disparaître entièrement de l'erlenmeyer. La réaction (1) ne pourra plus se faire : les ions BM+(aq) responsables de la couleur bleue ne pourront donc plus apparaître.
