Énoncé
Les ions ferreux essentiels pour le transport du dioxygène dans le sang (10 points)
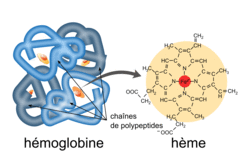 |
Transportées par les globules rouges dans la circulation sanguine, les molécules d'hémoglobine assurent l'apport du dioxygène aux différents organes des animaux vertébrés.
L'hémoglobine est un assemblage de quatre sous-unités qui abritent chacune une structure chimique particulière nommée "hème". Chaque hème contient un ion ferreux Fe2+. Cet ion Fe2+ est responsable de la fixation d'une molécule de dioxygène.
Certains polluants ou toxines présents dans le sang peuvent oxyder les ions ferreux Fe2+ en ions ferriques Fe3+ qui n'ont pas la capacité de fixer le dioxygène. Il est donc important que l'élément fer de l'hème ne soit pas oxydé et reste sous la forme d'ion Fe2+.
Dans cet exercice, on étudie d'abord l'oxydation des ions ferreux en ions ferriques. Ensuite, une méthode de dosage de l'hémoglobine dans le sang et le traitement d'une carence en fer sont abordés.
L'hémoglobine est un assemblage de quatre sous-unités qui abritent chacune une structure chimique particulière nommée "hème". Chaque hème contient un ion ferreux Fe2+. Cet ion Fe2+ est responsable de la fixation d'une molécule de dioxygène.
Certains polluants ou toxines présents dans le sang peuvent oxyder les ions ferreux Fe2+ en ions ferriques Fe3+ qui n'ont pas la capacité de fixer le dioxygène. Il est donc important que l'élément fer de l'hème ne soit pas oxydé et reste sous la forme d'ion Fe2+.
Dans cet exercice, on étudie d'abord l'oxydation des ions ferreux en ions ferriques. Ensuite, une méthode de dosage de l'hémoglobine dans le sang et le traitement d'une carence en fer sont abordés.
1. Oxydation des ions ferreux
Une expérience est menée en laboratoire pour illustrer la capacité de l'ion permanganate à oxyder les ions ferreux.
Dans un bécher contenant 40 mL d'une solution de sulfate de fer(II)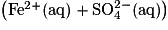 de concentration en quantité de matière égale à
de concentration en quantité de matière égale à 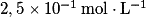 , on introduit 20 mL d'une solution aqueuse de permanganate de potassium
, on introduit 20 mL d'une solution aqueuse de permanganate de potassium 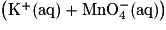 de concentration en quantité de matière égale à 1,0 × 10−1 mol·L−1, contenant aussi des ions H+. Les solutions avant mélange et après mélange ont été photographiées et figurent ci-dessous :
de concentration en quantité de matière égale à 1,0 × 10−1 mol·L−1, contenant aussi des ions H+. Les solutions avant mélange et après mélange ont été photographiées et figurent ci-dessous :
Dans un bécher contenant 40 mL d'une solution de sulfate de fer(II)
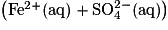 de concentration en quantité de matière égale à
de concentration en quantité de matière égale à 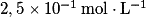 , on introduit 20 mL d'une solution aqueuse de permanganate de potassium
, on introduit 20 mL d'une solution aqueuse de permanganate de potassium 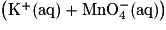 de concentration en quantité de matière égale à 1,0 × 10−1 mol·L−1, contenant aussi des ions H+. Les solutions avant mélange et après mélange ont été photographiées et figurent ci-dessous :
de concentration en quantité de matière égale à 1,0 × 10−1 mol·L−1, contenant aussi des ions H+. Les solutions avant mélange et après mélange ont été photographiées et figurent ci-dessous :
|
| ||
| Solution de permanganate de potassium (1) et solution de sulfate de fer (2) avant introduction de la solution (1) dans (2). | Solution obtenue après mélange des deux solutions. |
Données :
- Les espèces chimiques ci-dessous colorent toute solution aqueuse qui les contient.
| Espèce chimique | Fe2+ | Fe3+ | 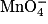 | Mn2+ |
| Coloration de la solution aqueuse | Verdâtre | Orangée | Violacée coloration intense | Incolore |
- Couples oxydant/réducteur :
• Fe3+ (aq)/Fe2+ (aq)
• 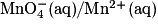 , dont la demi-équation électronique s'écrit :
, dont la demi-équation électronique s'écrit :
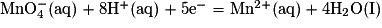 .
.
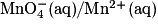 , dont la demi-équation électronique s'écrit :
, dont la demi-équation électronique s'écrit :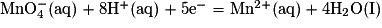 .
.1.1. À l'aide des observations, montrer qu'une transformation chimique a bien eu lieu.
Observer la couleur de chaque solution, avant mélange et après mélange.
1.2. Identifier les oxydants et les réducteurs consommés, et ceux qui sont produits.
Il y a réaction d'oxydoréduction entre les ions responsables de la couleur des deux solutions (1) et (2) de la photographie de l'énoncé.
1.3. On souhaite modéliser la transformation par une réaction oxydant-réducteur.
1.3.1. Écrire la demi-équation électronique du couple Fe3+ (aq)/Fe2+ (aq)
La demi-équation électronique concerne le couple du fer. L'équilibrage des charges se fait en ajoutant des électrons.
1.3.2. Vérifier que l'équation de la réaction oxydant-réducteur modélisant la transformation chimique s'écrit : 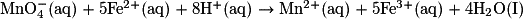 .
.
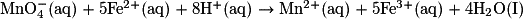 .
.Poser les deux demi-équations d'oxydoréduction puis ajuster les nombres stœchiométriques pour pouvoir équilibrer les électrons.
1.3.3. Justifier, à l'aide des données, que 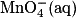 et Fe2+ (aq) sont introduits en proportions stœchiométriques dans le mélange initial.
et Fe2+ (aq) sont introduits en proportions stœchiométriques dans le mélange initial.
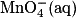 et Fe2+ (aq) sont introduits en proportions stœchiométriques dans le mélange initial.
et Fe2+ (aq) sont introduits en proportions stœchiométriques dans le mélange initial.Déterminer les quantités d'ions permanganate et d'ions ferreux introduites, puis vérifier ces quantités avec la stœchiométrie de la réaction.
Cette modélisation de la transformation sert de support pour rédiger un programme en langage python. Ce programme permet de visualiser l'évolution des quantités de matière des ions permanganate et des ions ferreux dans le système précédent, en fonction de l'avancement de la réaction noté x.
Extrait du programme rédigé en langage python :
Extrait du programme rédigé en langage python :
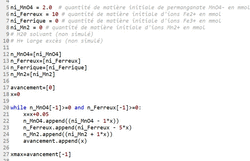 |
Représentations graphiques de l'évolution des quantités de matière calculées par le programme :
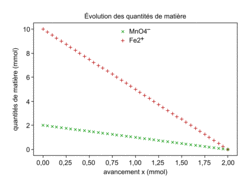 |
1.4. Indiquer la ligne du programme codant l'information correspondant à une transformation totale. Justifier.
Comme les réactifs sont introduits en proportions stœchiométriques, si la réaction est totale, il n'en restera plus à la fin.
1.5. Établir un tableau d'avancement de la réaction et vérifier que la valeur de l'avancement maximal est compatible avec le tracé de la figure 1.
Dans un premier temps, établir le tableau d'avancement de la réaction. Les réactifs, d'après la question précédente, sont introduits en proportions stœchiométriques donc il n'en restera plus à la fin de la transformation. La valeur de l'avancement maximal est tirée directement du tableau d'avancement. L'avancement maximal correspond à l'avancement lorsque la transformation s'est arrêtée donc lorsqu'il n'y a plus de réactif.
1.6. Déduire du tableau d'avancement l'expression de la quantité de matière des ions Fe3+ (aq) en fonction de l'avancement.
Il s'agit d'une simple lecture du tableau d'avancement.
1.7. Écrire l'instruction permettant de calculer la quantité de matière de Fe3+ (aq) pour une valeur d'avancement x, et proposer un numéro de ligne où elle pourrait être insérée dans le programme.
Il faut s'aider de la réponse à la question précédente. Les instructions de calcul sont mises dans la boucle "Tant que". On pourra s'aider des instructions déjà présentes pour la syntaxe du langage.
1.8. Reproduire la figure 1 sur votre copie et tracer la représentation graphique de l'évolution de la quantité de matière d'ions Mn2+ (aq) et celle de la quantité de matière d'ions Fe3+ (aq).
Trouver les relations qui lient la quantité de matière de chacun des ions à l'avancement de la réaction. On cherche à représenter ces deux quantités de matière.
2. Dosage de l'hémoglobine et traitement d'une carence en fer
Quand l'organisme souffre d'une carence en fer, les hèmes des globules rouges qui contiennent des ions Fe2+ ne sont plus suffisamment nombreux. Le taux d'hémoglobine est alors trop faible pour assurer une oxygénation normale des organes. Un dosage de ce taux permet de diagnostiquer une éventuelle carence et de prescrire un traitement adapté.
Principe du dosage de l'hémoglobine dans le sang par la « méthode de Drabkin »
Principe du dosage de l'hémoglobine dans le sang par la « méthode de Drabkin »
Le réactif de Drabkin permet de transformer l'hémoglobine d'un échantillon de sang en cyanméthémoglobine. On réalise ensuite un dosage spectrophotométrique de la cyanméthémoglobine dans l'échantillon analysé.
Protocole simplifié du dosage :
Protocole simplifié du dosage :
- ajout de 5 mL du réactif de Drabkin dans 20 μL d'échantillon de sang analysé ;
- mesure de l'absorbance A de la solution, obtenue à une longueur d'onde de 546 nm ;
- ajout de 5 mL du réactif de Drabkin dans 20 μL d'échantillons de référence de concentrations connues en hémoglobine. Mesures d'absorbance et tracé d'une droite d'étalonnage (figure 2).
 |
Données :
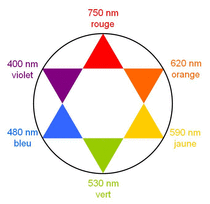
Cercle chromatique :
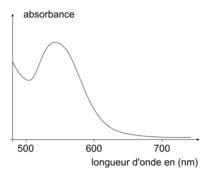
| Spectre d'absorption d'une solution aqueuse de cyanméthémoglobine :
|
Masses molaires :
Concentrations massiques en hémoglobine du sang permettant de diagnostiquer une carence en fer :
Source : rapport 2016 de l'Organisation mondiale de la santé (OMS)
« Évaluation de l'importance de la malnutrition par carence en micronutriments sur le plan de la santé publique »
Recommandations pour le traitement d'une carence en fer :
Dans le cas d'une carence en fer chez les femmes, le traitement préconisé est un apport quotidien équivalent à 50 mg d'ions Fe2+ en carence légère, et à 100 mg pour une carence modérée. Chez les hommes, l'apport doit être de 100 mg pour une carence légère, et 200 mg pour une carence modérée.
Source : rapport 2016 de l'Organisation mondiale de la santé (OMS)
Extrait de l'étiquette d'un médicament pour traiter une carence en fer :
- hémoglobine : M(Hb) = 64× 103 g·mol−1 ;
- soufre : M(S) = 32,0 g·mol−1 ; oxygène : M(O) = 16 g·mol−1 ; fer : M(Fe) = 55.8 g·mol−1.
Concentrations massiques en hémoglobine du sang permettant de diagnostiquer une carence en fer :
| Taux d'hémoglobine en g par litre de sang | Taux normal | Carence légère | Carence modérée | Carence sévère |
| Homme (> 15 ans) | 135 – 175 g/L | 110 – 130 g/L | 80 – 110 g/L | < 80 g/L |
| Femme (> 15 ans) | 115 – 155 g/L | 100 – 110 g/L | 70 – 100 g/L | < 70 g/L |
Source : rapport 2016 de l'Organisation mondiale de la santé (OMS)
« Évaluation de l'importance de la malnutrition par carence en micronutriments sur le plan de la santé publique »
Recommandations pour le traitement d'une carence en fer :
Dans le cas d'une carence en fer chez les femmes, le traitement préconisé est un apport quotidien équivalent à 50 mg d'ions Fe2+ en carence légère, et à 100 mg pour une carence modérée. Chez les hommes, l'apport doit être de 100 mg pour une carence légère, et 200 mg pour une carence modérée.
Source : rapport 2016 de l'Organisation mondiale de la santé (OMS)
Extrait de l'étiquette d'un médicament pour traiter une carence en fer :
- comprimés pour traitement curatif ou préventif d'une carence en fer ;
- principe actif : Fer sous forme de sulfate ferreux desséché (FeSO4) ;
- composition : Sulfate ferreux desséché 136,00 mg par comprimé.
2.1. Prévoir la teinte d'une solution aqueuse de cyanméthémoglobine.
Observer le spectre d'absorption de la solution aqueuse de cyanméthémoglobine et le cercle chromatique.
2.2. Expliquer le choix de la longueur d'onde de mesure d'absorbance.
Utiliser le spectre d'absorption de la solution aqueuse de cyanméthémoglobine.
2.3. Un échantillon de sang d'une femme est analysé par la méthode de Drabkin. L'absorbance mesurée est A = 0,26.
2.3.1. Indiquer si une carence en fer est diagnostiquée.
Pour diagnostiquer une carence en fer, il faut trouver la concentration massique en hémoglobine de l'échantillon. Il faut commencer par concentration molaire avec la courbe d'étalonnage.
2.3.2. Proposer un traitement adapté en déterminant le nombre de comprimés à prescrire par jour.
Les recommandations pour le traitement de la carence et la composition du médicament permettent de répondre à la question.
Corrigé
1.1 La solution de permanganate de potassium est violacée. La solution de sulfate de fer est verdâtre. Après mélange de ces deux solutions, on obtient une solution orangée due à la présence d'ion fer(III), Fe3+. Les ions Fe2+ se sont donc oxydés. Comme la couleur violette des ions permanganate a disparu, les ions permanganate se sont réduits en ions Mn2+ qui sont incolores. La réaction a donc bien eu lieu.
1.2. Les ions mis en présence dans les réactifs sont Fe2+ qui est un réducteur, et 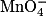 qui est un oxydant. Ils sont donc consommés au cours de la réaction.
qui est un oxydant. Ils sont donc consommés au cours de la réaction.
Les produits obtenus sont Fe3+ qui est un oxydant, et Mn2+ qui est un réducteur.
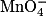 qui est un oxydant. Ils sont donc consommés au cours de la réaction.
qui est un oxydant. Ils sont donc consommés au cours de la réaction.Les produits obtenus sont Fe3+ qui est un oxydant, et Mn2+ qui est un réducteur.
1.3.1. La demi-équation d'oxydoréduction est Fe3+ (aq) + 1e− = Fe2+ (aq).
1.3.2. Les deux demi-équations d'oxydoréduction sont :
Fe3+ (aq) + 1e− = Fe2+ (aq) ;
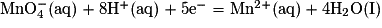 .
.
En inversant la première et en multipliant par 5 tous les nombres stœchiométriques, on obtient 5Fe2+ (aq) = 5Fe3+ (aq) + 5e−.
On ajoute alors membre à membre (en ne notant pas les électrons). On obtient :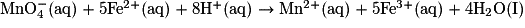 .
.
Fe3+ (aq) + 1e− = Fe2+ (aq) ;
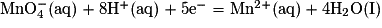 .
.En inversant la première et en multipliant par 5 tous les nombres stœchiométriques, on obtient 5Fe2+ (aq) = 5Fe3+ (aq) + 5e−.
On ajoute alors membre à membre (en ne notant pas les électrons). On obtient :
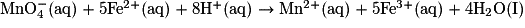 .
.1.3.3. Calcul des quantités de matières des réactifs :
n(Fe2+) = C × V = 2,5 × 10−1 × 40 × 10−3 = 1,0× 10−2 mol.
n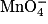 = C × V = 1,0 × 10−1 × 20 × 10−3 = 2,0× 10−3 mol.
= C × V = 1,0 × 10−1 × 20 × 10−3 = 2,0× 10−3 mol.
D'après l'équation de la réaction, pour que le mélange soit stœchiométrique, il faut que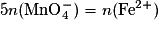 . Or
. Or 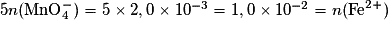 .
.
Les réactifs sont donc introduits en proportions stœchiométriques.
n(Fe2+) = C × V = 2,5 × 10−1 × 40 × 10−3 = 1,0× 10−2 mol.
n
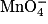 = C × V = 1,0 × 10−1 × 20 × 10−3 = 2,0× 10−3 mol.
= C × V = 1,0 × 10−1 × 20 × 10−3 = 2,0× 10−3 mol.D'après l'équation de la réaction, pour que le mélange soit stœchiométrique, il faut que
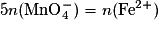 . Or
. Or 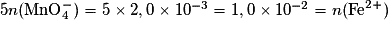 .
.Les réactifs sont donc introduits en proportions stœchiométriques.
1.4. À la fin de la réaction, il ne restera plus de réactif : la ligne 20 indique de faire un certain nombre d'instructions tant que la quantité d'ions permanganate et la quantité d'ions ferreux ne sont pas nulles. La transformation est supposée ici totale.
1.5. Le tableau d'avancement est
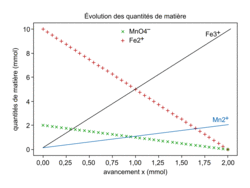
À la fin de la réaction, il ne reste plus d'ion permanganate :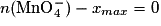 , donc xmax = 2,0 × 10−3 mol. On voit sur la figure 1 que l'avancement final est bien 2,00 mmol, ce qui est en accord avec les résultats du tableau d'avancement.
, donc xmax = 2,0 × 10−3 mol. On voit sur la figure 1 que l'avancement final est bien 2,00 mmol, ce qui est en accord avec les résultats du tableau d'avancement.
| | | 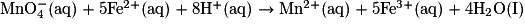 | |||||
| État | Avancement(en mol) | Quantité de matière (en mol) | |||||
| Initial | x = 0 | 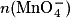 | n(Fe2+) | Excès | 0 | 0 | Solvant |
| En cours | x | 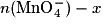 | n(Fe2+) − x | Excès | x | 5 x | Solvant |
| Final | xmax | 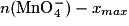 | n(Fe2+) − xmax | Excès | xmax | 5 xmax | Solvant |
À la fin de la réaction, il ne reste plus d'ion permanganate :
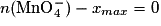 , donc xmax = 2,0 × 10−3 mol. On voit sur la figure 1 que l'avancement final est bien 2,00 mmol, ce qui est en accord avec les résultats du tableau d'avancement.
, donc xmax = 2,0 × 10−3 mol. On voit sur la figure 1 que l'avancement final est bien 2,00 mmol, ce qui est en accord avec les résultats du tableau d'avancement.1.6. D'après le tableau d'avancement, n(Fe3+) = 5x.
1.7. Le script de l'instruction permettant de calculer et de stocker la quantité de matière de Fe3+ (aq) est : n_Ferrique.append(ni_Ferrique + 5*x)
On pourra placer cette instruction entre les lignes 22 et 25 dans le corps de la boucle "Tant que", et après l'incrémentation de la variable x.
1.8. D'après le tableau d'avancement les quantités de matière d'ions Mn2+ (aq) et Fe3+ (aq) sont 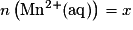 et
et 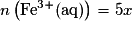 .
.
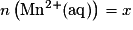 et
et 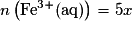 .
.À la fin, on a 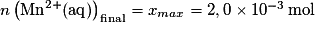 et
et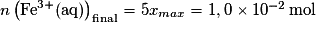 .
.
On obtiendra ainsi :
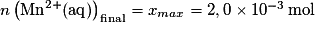 et
et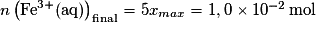 .
.On obtiendra ainsi :
 |
2.1. D'après le spectre d'absorption de la solution aqueuse de cyanméthémoglobine, on note un maximum d'absorption pour une longueur d'onde d'environ λ = 540nm. D'après le cercle chromatique, cette valeur d'absorption correspond à la couleur rouge. La solution de cyanméthémoglobine est donc rouge.
2.2. On se place toujours au maximum d'absorption de la solution étudiée. D'après la question précédente, ce maximum est obtenu pour une longueur d'onde d'environ λ = 540 nm. L'énoncé propose 546 nm ce qui est en accord avec la valeur trouvée.
2.3.1. Avec la courbe d'étalonnage donnant l'absorbance en fonction de la concentration en hémoglobine, l'abscisse du point ayant pour ordonnée A = 0,26 est C = 1,4 mmol/L.
 |
Or la masse molaire de l'hémoglobine est M(Hb) = 64 × 103 g·mol−1. Donc la concentration massique en hémoglobine de l'échantillon est Cm = C × M(Hb) = 1,4 × 10−3 × 64 × 103 = 90 g·mol−1.
D'après le tableau de référence de diagnostic, on peut dire que la patiente présente une carence modérée.
D'après le tableau de référence de diagnostic, on peut dire que la patiente présente une carence modérée.
2.3.2. Pour une carence modérée chez la femme, il faut un apport quotidien de 100 mg d'ions Fe2+.
Or un comprimé de sulfate ferreux contient 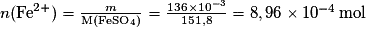 , avec
, avec 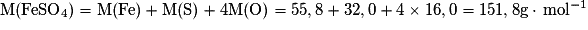 .
.
Soit une masse en ions Fe2+ m(Fe2+) × M(Fe2+) = 8,96 × 10−4 × 55,8 = 5,00 × 10−2 g = 50,00 mg.
Il faut donc qu'elle ingère deux comprimés par jour.
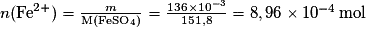 , avec
, avec 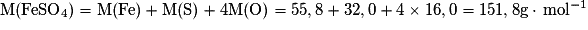 .
.Soit une masse en ions Fe2+ m(Fe2+) × M(Fe2+) = 8,96 × 10−4 × 55,8 = 5,00 × 10−2 g = 50,00 mg.
Il faut donc qu'elle ingère deux comprimés par jour.