Signaler une erreur
Ressources pour les enseignants - Base documentaire en SVT
Modèle tridimensionnel d'une molécule d'anticorps
Ressources pour les enseignants - Base documentaire en SVT
Modèle tridimensionnel d'une molécule d'anticorps
Imprimer
Ressources pour les enseignants - Base documentaire en SVT
Modèle tridimensionnel d'une molécule d'anticorps
Ressources pour les enseignants - Base documentaire en SVT
Modèle tridimensionnel d'une molécule d'anticorps
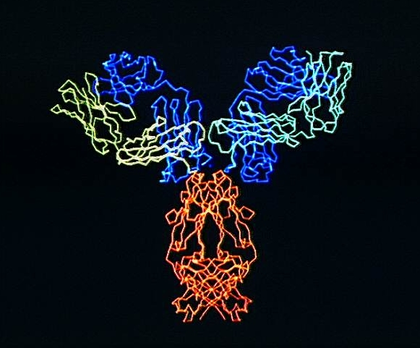 |
Le document présente une reconstruction tridimensionnelle d'un modèle moléculaire d'immunoglobuline G (IgG) obtenu par ordinateur. Les immunoglobulines G ou gamma-globulines sont des anticorps sécrétés par les plasmocytes et des récepteurs membranaires.
La représentation utilisée ne montre que le squelette carboné de la protéine dont les différentes parties sont identifiées par des couleurs différentes. Chaque molécule d'IgG a grossièrement la forme d'un Y et elle est formée de quatre chaînes protéiques identiques deux à deux, deux chaînes lourdes et deux chaînes légères, reliées par des ponts disulfures. Chaque chaîne comporte une partie constante et une partie variable qui lui confère sa spécificité. Les parties variables d'une chaîne lourde et d'une chaîne légère sont juxtaposées aux extrémités des deux branches du Y où elles constituent le site de reconnaissance et de liaison à l'antigène.
Des mécanismes génétiques complexes permettent la production d'une variété considérable de parties variables et donc d'anticorps différents. La liaison anticorps-antigènes donne des complexes immuns dans lesquels les antigènes sont immobilisés. Ils sont ensuite détruits soit par phagocytose, soit par l'action du complément. Les molécules d'anticorps constituent également les récepteurs B, récepteurs membranaires spécifiques des lymphocytes B, liés à la membrane par la base du Y.
La représentation utilisée ne montre que le squelette carboné de la protéine dont les différentes parties sont identifiées par des couleurs différentes. Chaque molécule d'IgG a grossièrement la forme d'un Y et elle est formée de quatre chaînes protéiques identiques deux à deux, deux chaînes lourdes et deux chaînes légères, reliées par des ponts disulfures. Chaque chaîne comporte une partie constante et une partie variable qui lui confère sa spécificité. Les parties variables d'une chaîne lourde et d'une chaîne légère sont juxtaposées aux extrémités des deux branches du Y où elles constituent le site de reconnaissance et de liaison à l'antigène.
Des mécanismes génétiques complexes permettent la production d'une variété considérable de parties variables et donc d'anticorps différents. La liaison anticorps-antigènes donne des complexes immuns dans lesquels les antigènes sont immobilisés. Ils sont ensuite détruits soit par phagocytose, soit par l'action du complément. Les molécules d'anticorps constituent également les récepteurs B, récepteurs membranaires spécifiques des lymphocytes B, liés à la membrane par la base du Y.
Signaler une erreur
Ressources pour les enseignants - Base documentaire en SVT
Modèle tridimensionnel d'une molécule d'anticorps
Ressources pour les enseignants - Base documentaire en SVT
Modèle tridimensionnel d'une molécule d'anticorps
Imprimer
Ressources pour les enseignants - Base documentaire en SVT
Modèle tridimensionnel d'une molécule d'anticorps
Ressources pour les enseignants - Base documentaire en SVT
Modèle tridimensionnel d'une molécule d'anticorps

