Énoncé
Mots-clés : réactions acide-base, réactions d'oxydoréduction, dosage par étalonnage.
Une boisson de réhydratation, obtenue par dissolution dans l'eau d'un médicament commercialisé sous forme de poudre, est composée principalement d'eau, de glucose (sucre) et de chlorure de sodium (sel). Elle peut être utilisée pour réhydrater rapidement un enfant souffrant de diarrhée.
L'objectif de cet exercice est de vérifier la teneur en glucose de l'une de ces boissons par la spectrophotométrie UV-visible.
Une boisson de réhydratation, obtenue par dissolution dans l'eau d'un médicament commercialisé sous forme de poudre, est composée principalement d'eau, de glucose (sucre) et de chlorure de sodium (sel). Elle peut être utilisée pour réhydrater rapidement un enfant souffrant de diarrhée.
L'objectif de cet exercice est de vérifier la teneur en glucose de l'une de ces boissons par la spectrophotométrie UV-visible.
Données
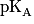 de couples acide-base à 25 degrés Celsius :
de couples acide-base à 25 degrés Celsius :
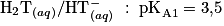 ;
;
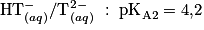 ;
;
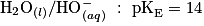 ;
;
Couple oxydant-réducteur ion gluconate/glucose :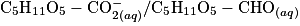 .
.
Composition d'un médicament permettant la réhydratation commercialisée en pharmacie :
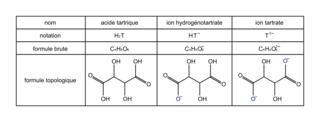
Différentes formes de l'acide tartrique :
 |
 de couples acide-base à 25 degrés Celsius :
de couples acide-base à 25 degrés Celsius :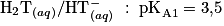 ;
;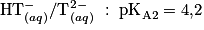 ;
;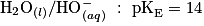 ;
;Couple oxydant-réducteur ion gluconate/glucose :
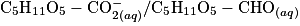 .
.Composition d'un médicament permettant la réhydratation commercialisée en pharmacie :
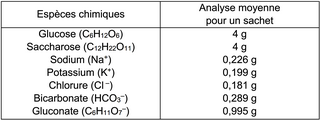 |
1. Étude de la liqueur de Fehling Pour doser le glucose présent dans un médicament permettant la réhydratation, on prépare au préalable une solution de liqueur de Fehling en mélangeant : une solution aqueuse (A) contenant des ions cuivre 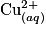 une solution aqueuse (B) obtenue lors du mélange d'une solution d'acide tartrique
une solution aqueuse (B) obtenue lors du mélange d'une solution d'acide tartrique 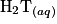 et d'une solution aqueuse d'hydroxyde de sodium. La solution (B) ainsi obtenue est très basique, son pH est supérieur à 12.
et d'une solution aqueuse d'hydroxyde de sodium. La solution (B) ainsi obtenue est très basique, son pH est supérieur à 12.
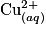 une solution aqueuse (B) obtenue lors du mélange d'une solution d'acide tartrique
une solution aqueuse (B) obtenue lors du mélange d'une solution d'acide tartrique 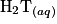 et d'une solution aqueuse d'hydroxyde de sodium. La solution (B) ainsi obtenue est très basique, son pH est supérieur à 12.
et d'une solution aqueuse d'hydroxyde de sodium. La solution (B) ainsi obtenue est très basique, son pH est supérieur à 12. 1.1. Écrire la formule semi-développée de la molécule d'acide tartrique. Entourer les groupes caractéristiques de la molécule, en précisant pour chacun d'eux la famille fonctionnelle correspondante.
Avec la formule topologique de l'acide tartrique donnée dans l'énoncé, déterminez sa formule semi-développée et ses groupes fonctionnels.
1.2. Déterminer la forme prédominante dans la solution (B) parmi les espèces 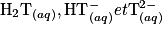 .
.
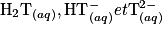 .
.Comparez le pH de la solution (B) avec les 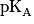 des différentes espèces.
des différentes espèces.
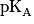 des différentes espèces.
des différentes espèces.1.3. En déduire l'équation de la réaction chimique modélisant la transformation ayant lieu lors de la préparation de la solution (B).
Pour préparer la solution (B), il faut faire réagir l'acide tartrique et la soude. Déterminez les deux couples acido-basiques en présence, puis écrivez l'équation modélisant la transformation acido-basique qui a lieu. Tenez compte de l'espèce qui prédomine à un tel pH.
Lors du mélange des solutions (A) et (B), les ions 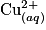 réagissent avec les ions tartrate
réagissent avec les ions tartrate 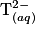 pour former des ions de formule
pour former des ions de formule 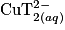 seuls responsables de la coloration bleue de la liqueur de Fehling.
seuls responsables de la coloration bleue de la liqueur de Fehling.
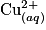 réagissent avec les ions tartrate
réagissent avec les ions tartrate 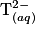 pour former des ions de formule
pour former des ions de formule 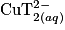 seuls responsables de la coloration bleue de la liqueur de Fehling.
seuls responsables de la coloration bleue de la liqueur de Fehling.1.4. Écrire l'équation de la réaction chimique modélisant la transformation ayant lieu lors du mélange des solutions (A) et (B).
La solution (A) contient des ions cuivre (II) et la solution (B) contient des ions tartrate. Le mélange des deux solutions conduit à la formation de 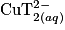 Soyez attentif à bien équilibrer la réaction modélisant cette transformation.
Soyez attentif à bien équilibrer la réaction modélisant cette transformation.
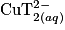 Soyez attentif à bien équilibrer la réaction modélisant cette transformation.
Soyez attentif à bien équilibrer la réaction modélisant cette transformation.Le spectre d'absorption de la liqueur de Fehling (figure 1) est donné ci-après, ainsi qu'un cercle chromatique (figure 2) :
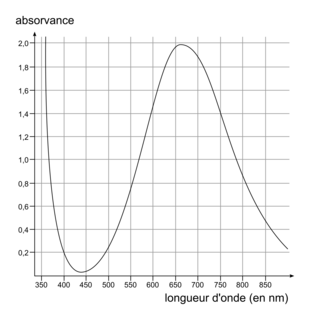 |
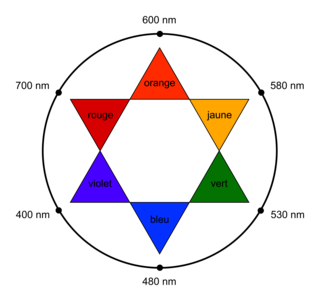 |
1.5. Justifier la couleur de la solution de liqueur de Fehling.
Déterminez le maximum d'absorption de la liqueur de Fehling. Avec le cercle chromatique, déterminez la couleur complémentaire de la couleur correspondant au maximum d'absorption.
2. Dosage du glucose Le médicament permettant la réhydratation contient, entre autres, du glucose qui possède des propriétés réductrices. On souhaite utiliser ces propriétés pour réaliser un dosage par étalonnage utilisant la spectrophotométrie.
On réalise une courbe d'étalonnage selon le protocole expérimental suivant : préparer une gamme de solutions aqueuses étalons de concentrations en masse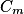 de glucose connues ; ces solutions étalons sont incolores ; faire réagir, une à une, 10,0 mL de ces solutions étalons avec 5,0 mL de liqueur de Fehling dans un bain-marie bouillant pendant 15 min, il se forme le précipité rouge-brique
de glucose connues ; ces solutions étalons sont incolores ; faire réagir, une à une, 10,0 mL de ces solutions étalons avec 5,0 mL de liqueur de Fehling dans un bain-marie bouillant pendant 15 min, il se forme le précipité rouge-brique 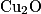 ; éliminer le précipité du mélange par filtration. Le filtrat obtenu est de couleur bleue ; introduire ce filtrat dans une fiole jaugée de 25,0 mL et ajuster le trait de jauge avec de l'eau distillée ; mesurer avec un spectrophotomètre l'absorbance de la solution de couleur bleue obtenue.
; éliminer le précipité du mélange par filtration. Le filtrat obtenu est de couleur bleue ; introduire ce filtrat dans une fiole jaugée de 25,0 mL et ajuster le trait de jauge avec de l'eau distillée ; mesurer avec un spectrophotomètre l'absorbance de la solution de couleur bleue obtenue.
Le glucose contenu dans le médicament permettant la réhydratation réagit avec les ions contenus dans la liqueur de Fehling. Cette transformation chimique est totale et produit l'ion gluconate et l'oxyde de cuivre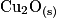 de couleur rouge brique. L'équation de la réaction modélisant cette transformation est :
de couleur rouge brique. L'équation de la réaction modélisant cette transformation est :
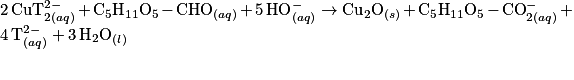 où
où 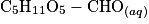 est le glucose et
est le glucose et 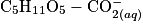 est l'ion gluconate.
est l'ion gluconate.
On réalise une courbe d'étalonnage selon le protocole expérimental suivant : préparer une gamme de solutions aqueuses étalons de concentrations en masse
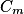 de glucose connues ; ces solutions étalons sont incolores ; faire réagir, une à une, 10,0 mL de ces solutions étalons avec 5,0 mL de liqueur de Fehling dans un bain-marie bouillant pendant 15 min, il se forme le précipité rouge-brique
de glucose connues ; ces solutions étalons sont incolores ; faire réagir, une à une, 10,0 mL de ces solutions étalons avec 5,0 mL de liqueur de Fehling dans un bain-marie bouillant pendant 15 min, il se forme le précipité rouge-brique 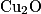 ; éliminer le précipité du mélange par filtration. Le filtrat obtenu est de couleur bleue ; introduire ce filtrat dans une fiole jaugée de 25,0 mL et ajuster le trait de jauge avec de l'eau distillée ; mesurer avec un spectrophotomètre l'absorbance de la solution de couleur bleue obtenue.
; éliminer le précipité du mélange par filtration. Le filtrat obtenu est de couleur bleue ; introduire ce filtrat dans une fiole jaugée de 25,0 mL et ajuster le trait de jauge avec de l'eau distillée ; mesurer avec un spectrophotomètre l'absorbance de la solution de couleur bleue obtenue.Le glucose contenu dans le médicament permettant la réhydratation réagit avec les ions contenus dans la liqueur de Fehling. Cette transformation chimique est totale et produit l'ion gluconate et l'oxyde de cuivre
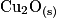 de couleur rouge brique. L'équation de la réaction modélisant cette transformation est :
de couleur rouge brique. L'équation de la réaction modélisant cette transformation est :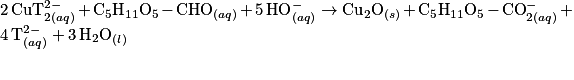 où
où 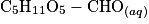 est le glucose et
est le glucose et 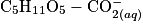 est l'ion gluconate.
est l'ion gluconate.2.1. Justifier le caractère réducteur du glucose dans cette réaction à l'aide d'une demi-équation électronique.
Identifiez la demi-équation électronique pour le couple d'oxydoréduction auquel appartient le glucose. Un oxydant est une espèce susceptible de capter des électrons.
2.2. À l'issue de la réaction entre une solution étalon de glucose et la solution de liqueur de Fehling, le filtrat est de couleur bleue. Identifier le réactif limitant.
Analysez la couleur du filtrat à l'issue de la réaction, ce qui vous permettra de déterminer l'espèce chimique en excès et ainsi le réactif limitant.
2.3. Proposer une longueur d'onde optimale pour régler le spectrophotomètre afin de réaliser les mesures.
Pour régler la longueur d'onde optimale du spectrophotomètre, il faut se placer au maximum d'absorption de l'espèce colorée.
La courbe d'étalonnage est obtenue à partir des mesures de l'absorbance des filtrats des différents mélanges. Elle est modélisée par une droite d'équation :
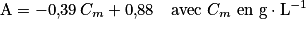 .
.
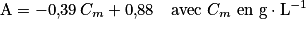 .
.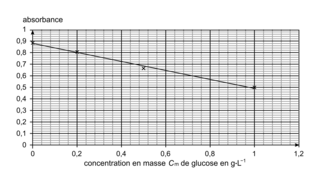 |
2.4. Expliquer pourquoi l'absorbance du filtrat diminue lorsque la concentration en masse de glucose augmente.
Le glucose est le réactif limitant. L'espèce responsable de la couleur de la solution est l'espèce en excès.
Afin de déterminer la masse de glucose contenue dans un sachet de médicament permettant la réhydratation, on réalise l'expérience suivante : une solution (S1) de volume est préparée en dissolvant le contenu d'un sachet de médicament dans de l'eau distillée ; la solution (S1) est ensuite diluée d'un facteur 10 pour obtenir la solution (S2) ; en réalisant le même protocole expérimental que pour les solutions étalons, on mesure une absorbance A = 0,59 lorsqu'on utilise 10,0 mL de solution (S2) à la place de 10,0 mL de solution étalon.
2.5. Déterminer la masse de glucose contenue dans le sachet de médicament permettant la réhydratation et commenter le résultat obtenu.
La valeur de l'absorbance et l'équation de la droite de la courbe d'étalonnage ou une lecture graphique permettent de déterminer la concentration de la solution (S2). Or celle-ci a été obtenue après dilution de la solution (S1). Calculez ensuite la masse de glucose présente dans le sachet qui a servi à préparer la solution (S1) et comparez-la à la valeur de référence.
Corrigé
1.1. La formule de l'acide tartrique est :
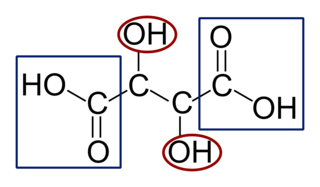 |
Les rectangles représentent la famille des acides carboxyliques et les cercles la famille des alcools.
1.2. Le pH de la solution (B) est supérieur à 12. Or 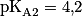 Donc la forme prédominante est l'ion tartrate
Donc la forme prédominante est l'ion tartrate 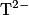 .
.
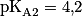 Donc la forme prédominante est l'ion tartrate
Donc la forme prédominante est l'ion tartrate 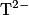 .
.1.3. La solution (B) est obtenue en faisant réagir l'acide tartrique sur la soude. La réaction modélisant la transformation ayant lieu est :
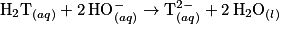 .
.
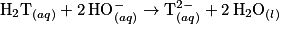 .
.1.4. L'équation de la réaction modélisant la transformation ayant lieu lors du mélange des solutions (A) et (B) est :
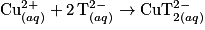 .
.
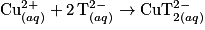 .
.1.5. Le maximum d'absorption de la liqueur de Fehling est obtenu pour une longueur d'onde qui correspond à la couleur rouge orange. La couleur de la solution de liqueur de Fehling est donc sa couleur complémentaire, c'est-à-dire bleu vert.
2.1. La demi-équation électronique en milieu acide est :
 .
.
 .
.2.2. Le filtrat à l'issue de la réaction est bleu. Or la couleur bleue est due à la présence des ions 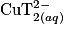 de la liqueur de Fehling, qui sont donc en excès. Ainsi, le réactif limitant est le glucose.
de la liqueur de Fehling, qui sont donc en excès. Ainsi, le réactif limitant est le glucose.
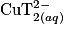 de la liqueur de Fehling, qui sont donc en excès. Ainsi, le réactif limitant est le glucose.
de la liqueur de Fehling, qui sont donc en excès. Ainsi, le réactif limitant est le glucose.2.3. L'espèce colorée ici correspond aux ions 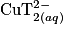 qui ont un maximum d'absorption pour une longueur d'onde de 670 nm. Il faut régler la longueur d'onde du spectrophotomètre autour de cette valeur.
qui ont un maximum d'absorption pour une longueur d'onde de 670 nm. Il faut régler la longueur d'onde du spectrophotomètre autour de cette valeur.
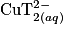 qui ont un maximum d'absorption pour une longueur d'onde de 670 nm. Il faut régler la longueur d'onde du spectrophotomètre autour de cette valeur.
qui ont un maximum d'absorption pour une longueur d'onde de 670 nm. Il faut régler la longueur d'onde du spectrophotomètre autour de cette valeur.2.4. Le glucose étant le réactif limitant, plus la quantité de glucose augmente et moins il restera d'ions 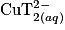 qui vont réagir avec le glucose. L'absorbance du filtrat va donc diminuer, plus la concentration en masse de glucose sera grande.
qui vont réagir avec le glucose. L'absorbance du filtrat va donc diminuer, plus la concentration en masse de glucose sera grande.
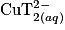 qui vont réagir avec le glucose. L'absorbance du filtrat va donc diminuer, plus la concentration en masse de glucose sera grande.
qui vont réagir avec le glucose. L'absorbance du filtrat va donc diminuer, plus la concentration en masse de glucose sera grande.2.5. L'absorption de la solution (S2) est A = 0,59. Avec l'équation de la droite de la courbe d'étalonnage 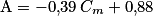 , on isole la concentration
, on isole la concentration 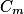 :
: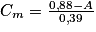 . Numériquement, on obtient
. Numériquement, on obtient 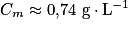 . Or la solution (S2) est obtenue en diluant 10 fois la solution (S1).
. Or la solution (S2) est obtenue en diluant 10 fois la solution (S1).
La concentration massique de la solution (S1) est donc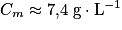 Comme
Comme 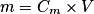 on obtient
on obtient 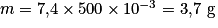 .
.
Le résultat de la mesure expérimentale est cohérent avec la valeur de référence (4 g) et l'étiquette précise qu'il s'agit d'une valeur moyenne.
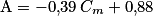 , on isole la concentration
, on isole la concentration 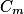 :
: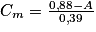 . Numériquement, on obtient
. Numériquement, on obtient 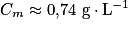 . Or la solution (S2) est obtenue en diluant 10 fois la solution (S1).
. Or la solution (S2) est obtenue en diluant 10 fois la solution (S1).La concentration massique de la solution (S1) est donc
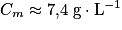 Comme
Comme 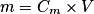 on obtient
on obtient 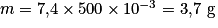 .
. Le résultat de la mesure expérimentale est cohérent avec la valeur de référence (4 g) et l'étiquette précise qu'il s'agit d'une valeur moyenne.

