Effectuer des bilans d'énergie sur un système : le premier principe de la thermodynamique et l'étude énergétique d'un système thermodynamique
Le premier principe permet de formaliser la relation qu'a un système avec l'environnement qui l'entoure. En effet, il retranscrit la conservation de l'énergie, à l'échelle de l'énergie interne d'un système en contact avec l'extérieur. Dans ce chapitre, on cherche à comprendre comment, à l'échelle macroscopique, de l'énergie est transférée à un système.
I. Qu'est-ce que l'énergie interne et l'énergie globale d'un système thermodynamique ?
En thermodynamique, on appelle système toute partie de l'univers isolée par la pensée. La portion restante de l'univers est alors appelée milieu extérieur. L'énergie interne U d'un système macroscopique est : U = ec + ep, somme de deux termes :
• l'énergie cinétique microscopique de chaque particule du système. Elle est fonction de l'agitation thermique, donc de la température. Elle est notée ici ec.
• l'énergie potentielle d'interactions microscopiques entre les particules (et/ou d'interactions macroscopiques internes pour les systèmes de grande taille). Elle est due aux interactions gravitationnelle, électromagnétique, forte et faible entre les particules du système. Elle est notée ici ep.
À l'énergie interne d'un système s'ajoute son énergie mécanique macroscopique Em = Ec + Ep. Il en résulte que l'énergie globale d'un système vaut : Etotale = U + Em = Ec + ec + Ep + ep.
II. Qu'est-ce que la variation d'énergie interne d'un système ?
D'après la relation précédente, la variation d'énergie totale d'un système est la somme de la variation de son énergie interne U et de la variation de son énergie mécanique Em. Quand l'énergie mécanique Em est constante, la variation d'énergie totale est due à la variation d'énergie interne.La variation d'énergie interne d'un système est donc liée aux échanges d'énergie avec l'extérieur, qui se font soit par un travail non conservatif W, soit par transfert thermique Q.
III. Qu'est-ce que le premier principe de la thermodynamique ?
L'expérience montre que lorsque l'on met en présence deux corps pris à des températures différentes, au bout d'un certain temps, leurs températures finissent par devenir les mêmes. Le corps chaud a donné de l'énergie thermique (calorifique) au corps froid. C'est le transfert thermique, que l'on note Q. À l'échelle macroscopique, un transfert thermique s'effectue toujours d'un corps chaud vers un corps froid. L'apport d'énergie calorifique à un corps peut, en réalité, avoir deux principaux effets :
• un accroissement de la température de ce corps, sans changement d'état physique ;
• le changement d'état du corps, correspondant au passage d'une substance d'un état (solide, liquide, gazeux) à un autre. Pour les corps purs, la pression et la température restent constantes.
Le premier principe de la thermodynamique formalise la relation entre la variation de l'énergie interne d'un côté et les transferts d'énergie de l'autre. Il s'écrit : ΔU = Q + W, avec ΔU la variation d'énergie interne, Q et W respectivement la chaleur et le travail échangés avec l'extérieur. Ces trois grandeurs s'expriment en joules (J).
Par convention, tout transfert d'énergie reçu par le système est compté positivement, et tout transfert d'énergie cédé par le système est compté négativement. On notera également que le travail W ne concerne que les forces non conservatives (frottements, pression, etc.). En effet, le travail des forces conservatives est déjà pris en compte dans le terme d'énergie mécanique (qui est considéré comme invariant ici).
Par convention, tout transfert d'énergie reçu par le système est compté positivement, et tout transfert d'énergie cédé par le système est compté négativement. On notera également que le travail W ne concerne que les forces non conservatives (frottements, pression, etc.). En effet, le travail des forces conservatives est déjà pris en compte dans le terme d'énergie mécanique (qui est considéré comme invariant ici).
IV. Comment calculer un transfert thermique ?
La capacité thermique, notée C est déterminée par la quantité d'énergie à apporter par transfert thermique (échange de chaleur) pour élever d'un kelvin la température d'une substance. Comme elle dépend du corps, de son état physique et de sa masse m, on utilise souvent la capacité thermique massique c définie par :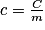 exprimée en
exprimée en 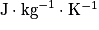 .
.On a vu précédemment que la mise en contact de deux corps à des températures différentes donne lieu à un transfert thermique. En effet, l'expérience montre que l'énergie thermique (ou quantité de chaleur) Q échangée avec l'environnement par une masse m de substance dont la température varie de Tinitial à Tfinal peut s'écrire : Q = m × c × (Tfinal − Tinitial) = ΔU.
Q est positif si la masse m s'échauffe (l'énergie interne augmente). Q est négatif si la masse m se refroidit.
V. Quelles sont les différentes formes de transfert thermique ?
On parle de transfert thermique par conduction si les particules d'une zone chaude d'un système augmentent, par collisions et de proche en proche, l'agitation thermique et donc la température des particules froides d'un système. Ce transfert thermique se fait sans transfert de matière.Il y a transfert thermique par convection lorsqu'un fluide chaud en mouvement transmet son énergie thermique aux fluides froids ou aux parois avec lequel il entre en contact, ou inversement. Dans ce cas, il y a transfert de matière.
Le transfert thermique par rayonnement désigne tout transfert thermique causé par des ondes électromagnétiques, en particulier infrarouges. Les corps qui captent ces radiations s'échauffent alors. Il n'y a que les particules de lumière (photons) qui sont en mouvement dans ce cas. Par exemple, le Soleil fournit de l'énergie à la Terre par ce biais.
VI. Qu'est-ce que le flux thermique ?
Transferts d'énergie entre systèmes macroscopiques
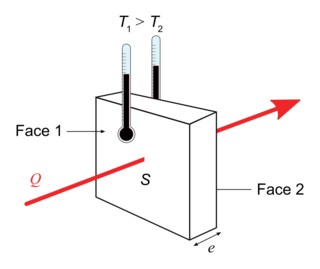 |
On appelle flux thermique l'énergie transférée à travers une paroi par unité de temps. Ce transfert se fait spontanément de la source chaude vers la source froideρ; il est irréversible. Si on appelle Q l'énergie transférée à travers une paroi pendant une durée Δt on définit le flux thermique Φ à travers cette paroi par : 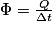 , exprimé en watt (W).
, exprimé en watt (W).
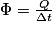 , exprimé en watt (W).
, exprimé en watt (W).Notion-clé
Le bilan d'énergie
Faire le bilan d'énergie d'un système permet de retranscrire de façon quantitative, en utilisant le premier principe de la thermodynamique, toutes les interactions (au sens énergétique) qu'a un système avec l'extérieur. Le bilan énergétique doit suivre le protocole suivant :
• donner le système macroscopique étudié ;
• noter la nature des transferts énergétiques (travail, transfert thermique par conduction, etc.) entre le système choisi et l'extérieur ;
• noter le sens de chaque transfert en utilisant la convention : signe positif si le système reçoit, signe négatif si le système cède.
Exemple : la pompe à chaleur.
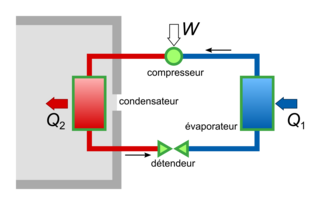 |
Le système est la pompe à chaleur. Le bilan du système est : W + Q1 − Q2 = ΔU.
Comme la température du système reste constante : ΔU = 0, d'où Q1 + W = Q2.
Comme la température du système reste constante : ΔU = 0, d'où Q1 + W = Q2.
Zoom sur…
Le bilan radiatif du système Terre
On cherche à effectuer un bilan thermique du système Terre afin d'estimer sa température moyenne, en se basant sur le rayonnement qu'elle reçoit du Soleil. Pour cela, on fait deux hypothèses.
Tout d'abord, on considère la planète prise dans son ensemble dans un état stationnaire : la puissance surfacique thermique émise par la Terre correspond à la puissance surfacique thermique moyenne reçue par rayonnement solaire, qui correspond à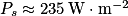 .
.
Ensuite, on suppose que la Terre est un corps noir, c'est-à-dire qu'elle absorbe parfaitement toute la lumière reçue par le Soleil. Cette hypothèse nous permet d'appliquer la loi de Stefan-Boltzmann, qui relie la température de la planète à la puissance qu'elle émet par rayonnement lumineux (infrarouge pour la Terre) :
Ps = σ × T4, avec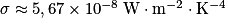 est la constante de Stefan-Boltzmann.
est la constante de Stefan-Boltzmann.
On obtient alors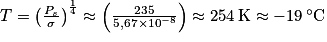 .
.
On sait, même sans faire de mesures précises, que la température moyenne sur Terre est plutôt proche de 15 °C que de −19 °C, en réalité.
Deux éléments peuvent expliquer l'écart observé :
Tout d'abord, on considère la planète prise dans son ensemble dans un état stationnaire : la puissance surfacique thermique émise par la Terre correspond à la puissance surfacique thermique moyenne reçue par rayonnement solaire, qui correspond à
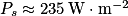 .
.Ensuite, on suppose que la Terre est un corps noir, c'est-à-dire qu'elle absorbe parfaitement toute la lumière reçue par le Soleil. Cette hypothèse nous permet d'appliquer la loi de Stefan-Boltzmann, qui relie la température de la planète à la puissance qu'elle émet par rayonnement lumineux (infrarouge pour la Terre) :
Ps = σ × T4, avec
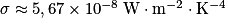 est la constante de Stefan-Boltzmann.
est la constante de Stefan-Boltzmann.On obtient alors
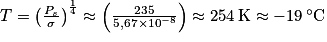 .
.On sait, même sans faire de mesures précises, que la température moyenne sur Terre est plutôt proche de 15 °C que de −19 °C, en réalité.
Deux éléments peuvent expliquer l'écart observé :
• une partie du rayonnement solaire n'est en fait pas absorbé par la Terre, c'est ce que l'on appelle l'albédo ;
• l'atmosphère, non prise en compte dans le modèle, joue un rôle important de réflexion et de transmission des flux thermiques, contribuant ainsi à une élévation de la température de la planète. C'est l'effet de serre.

