Prévoir le sens de l'évolution spontanée d'un système chimique et forcer son sens d'évolution
Fiche
On caractérise l'état d'un système chimique à l'équilibre par son quotient de réaction qui dépend des concentrations des réactifs et des produits. Quelles que soient les conditions initiales, un système tend toujours vers un même état d'équilibre, caractérisé par sa constante d'équilibre à une température donnée.
I. Qu'est-ce que le quotient de réaction Qr ?
Le quotient de réaction caractérise l'avancement d'une réaction chimique et permet de prévoir son évolution. Soit la réaction chimique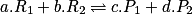 , avec a, b, c et d les coefficients de stœchiométrie de la réaction. À tout instant, le coefficient de réaction s'écrit :
, avec a, b, c et d les coefficients de stœchiométrie de la réaction. À tout instant, le coefficient de réaction s'écrit : ![Q_{r}= \frac{\left [ P_{1} \right ]^{c}\left [ P_{2}\right ]^{d}}{\left [ R_{1} \right ]^{a}\left [ R_{2} \right ]^{b}}](https://static1.assistancescolaire.com/t/images/t_speph_05_m2.png) .
.Si l'une des espèces est en large excès, on ne la fait pas figurer dans l'expression du quotient de réaction. C'est, par exemple, le cas de l'eau pour les réactions en solution aqueuse. Les éléments à l'état solide ne sont pas pris en compte non plus.
Remarque : cette relation s'étend aux cas où le nombre de réactifs et/ou de produits est différent de 2.
II. Qu'est-ce que la constante d'équilibre K(T) ?
Dans un délai plus ou moins long, lié à la vitesse de réaction, un système évolue de son état initial vers un état d'équilibre. On nomme constante d'équilibre, notée K, le quotient de réaction dans l'état d'équilibre d'une réaction donnée :
![\mathrm{K}=Q_{r,\acute{e}q}= \frac{\left [ P_{1,\acute{e}q} \right ]^{c}\left [ P_{2,\acute{e}q} \right ]^{d}}{\left [ R_{1,\acute{e}q} \right ]^{a}\left [ R_{2,\acute{e}q} \right ]^{b}}](https://static1.assistancescolaire.com/t/images/t_speph_05_m3.png)
K(T) est une grandeur sans unité qui ne dépend que de la température.
Cette constante sert de référence. Elle permet de prévoir l'évolution d'un système chimique si on la compare au quotient de réaction Qr. En effet, toute réaction chimique non totale évolue pour atteindre l'équilibre, symbolisé par Qr = K(T). Ainsi :
![\mathrm{K}=Q_{r,\acute{e}q}= \frac{\left [ P_{1,\acute{e}q} \right ]^{c}\left [ P_{2,\acute{e}q} \right ]^{d}}{\left [ R_{1,\acute{e}q} \right ]^{a}\left [ R_{2,\acute{e}q} \right ]^{b}}](https://static1.assistancescolaire.com/t/images/t_speph_05_m3.png)
K(T) est une grandeur sans unité qui ne dépend que de la température.
Cette constante sert de référence. Elle permet de prévoir l'évolution d'un système chimique si on la compare au quotient de réaction Qr. En effet, toute réaction chimique non totale évolue pour atteindre l'équilibre, symbolisé par Qr = K(T). Ainsi :
• si Qr = K(T), alors le système est à l'équilibre chimique ;
• si Qr < K(T), le système chimique va évoluer dans le sens direct, ce qui signifie que les quantités de réactifs vont diminuer, alors que celles des produits vont augmenter ;
• si Qr > K(T), alors le système va évoluer dans le sens inverse, ce qui signifie que les quantités de réactifs vont augmenter, alors que celles des produits vont diminuer.
Remarque : la constante d'acidité, KA, vue dans le chapitre sur les réactions acido-basiques, est une constante d'équilibre particulière.
III. Qu'est-ce qu'une réaction d'oxydoréduction (rappels de première) ?
Une réaction d'oxydoréduction résulte d'un transfert d'électrons entre le réducteur d'un couple et l'oxydant d'un autre couple. Ainsi, elle combine :
• la réduction d'un oxydant, s'écrivant 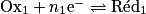 ;
;
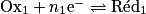 ;
;• l'oxydation d'un réducteur, s'écrivant 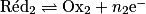 .
.
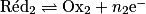 .
.Exemple : 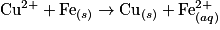 . Ici, c'est le fer qui joue le rôle de réducteur et l'ion Cu2+ celui d'oxydant.
. Ici, c'est le fer qui joue le rôle de réducteur et l'ion Cu2+ celui d'oxydant.
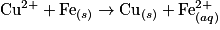 . Ici, c'est le fer qui joue le rôle de réducteur et l'ion Cu2+ celui d'oxydant.
. Ici, c'est le fer qui joue le rôle de réducteur et l'ion Cu2+ celui d'oxydant.• Exemples d'oxydants : eau de javel, dichlore, dioxygène (responsable de la rouille), ions métalliques.
• Exemples de réducteurs : hydrogène, acide ascorbique, métaux.
Pour écrire une équation d'oxydoréduction, la méthode est la suivante :
• écrire les deux demi-équations d'oxydoréduction (la réduction et l'oxydation) et les équilibrer ;
• multiplier les coefficients des demi-équations pour qu'il y ait autant d'électrons dans chacune d'entre elles. En effet, l'équation bilan ne doit contenir aucun électron ;
• additionner les deux demi-équations membre à membre et enlever les électrons de chaque côté de l'équation. Vérifier que les réactifs sont à gauche de l'équation et les produits à droite.
IV. Qu'est-ce qu'une transformation spontanée en oxydoréduction ?
Soit un bécher contenant un mélange de sulfate de cuivre et de sulfate de zinc présents en proportions équivalentes![\left ( \left [ \mathrm{Cu}^{2+} \right ]\approx \left [ \mathrm{Zn^{2+}} \right ] \right )](https://static1.assistancescolaire.com/t/images/t_speph_05_m7.png) . On trempe, dans ce bécher, une plaque de zinc et une plaque de cuivre. Au bout d'un certain temps, on constate l'apparition d'un dépôt rouge de cuivre métallique sur la plaque de zinc. La plaque de cuivre ne subit pas de changement.
. On trempe, dans ce bécher, une plaque de zinc et une plaque de cuivre. Au bout d'un certain temps, on constate l'apparition d'un dépôt rouge de cuivre métallique sur la plaque de zinc. La plaque de cuivre ne subit pas de changement.Essayons d'expliquer ce résultat. Le bécher a été le siège d'une réaction d'oxydoréduction par contact direct entre les ions
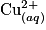 et le zinc. Le zinc est oxydé, alors que le cuivre est réduit, soit :
et le zinc. Le zinc est oxydé, alors que le cuivre est réduit, soit :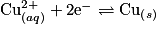
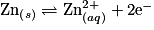
L'équation de réaction est donc :
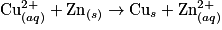 (2 électrons ont été échangés)
(2 électrons ont été échangés)La constante d'équilibre de cette réaction vaut, à température ambiante, K(T) = 2 × 1037.
Or, on a
![Q_{r,\, initial}= \frac{\left [ \mathrm{Zn}^{2+} \right ]}{\left [ \mathrm{Cu}^{2+} \right ]}\approx 1](https://static1.assistancescolaire.com/t/images/t_speph_05_m12.png) . Donc
. Donc 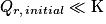 . On en déduit que la réaction évolue spontanément dans le sens direct, ce qui donne lieu à l'apparition de cuivre à l'état solide. Ceci est confirmé par l'apparition d'un dépôt rouge de cuivre métallique sur la plaque de zinc. Cela explique également pourquoi la plaque de cuivre ne subit pas de changement.
. On en déduit que la réaction évolue spontanément dans le sens direct, ce qui donne lieu à l'apparition de cuivre à l'état solide. Ceci est confirmé par l'apparition d'un dépôt rouge de cuivre métallique sur la plaque de zinc. Cela explique également pourquoi la plaque de cuivre ne subit pas de changement.V. Comment fonctionne une pile ?
Une pile est composée de deux demi-piles contenant chacune un couple oxydoréducteur. Les deux sont reliées par un pont salin, matériau poreux permettant la circulation des électrons. Un fil électrique relie les deux électrodes pour obtenir un circuit fermé. Une résistance et un ampèremètre sont ajoutés pour observer la circulation du courant.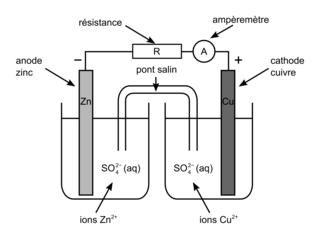 |
Le premier couple, correspondant à l'anode (borne (−) sur le schéma) va envoyer des électrons au travers du circuit électrique, qui vont être utilisés par le second couple dans l'autre demi-pile, la cathode (pôle (+) sur le schéma). Il y a transfert spontané indirect d'électrons de l'anode vers la cathode. Par convention, le courant va dans le sens inverse des électrons, soit du + vers le −.
Si on définit Δt comme étant le temps de fonctionnement maximum d'une pile, sa capacité électrique maximale correspondra à Qmax = I × Δt, avec I le courant électrique qu'elle fournit. Elle est proportionnelle au nombre d'électrons n pouvant être échangés dans le dispositif (en mol). Qmax = n × NA × e, avec NA la constante d'Avogadro, et e = 1,6 × 10−19 C = 1eV, la charge électrique d'un électron.
Pour calculer ce nombre n, il faut prendre le nombre d'électrons échangés par réaction (en partant des deux demi-réactions utilisées pour l'écrire) et le multiplier par l'avancement maximal de la réaction.
On associe également à une pile la tension à ses bornes U = E − rI, avec E la force électromotrice reliée aux réactifs dans la pile et r sa résistance interne.
Si on définit Δt comme étant le temps de fonctionnement maximum d'une pile, sa capacité électrique maximale correspondra à Qmax = I × Δt, avec I le courant électrique qu'elle fournit. Elle est proportionnelle au nombre d'électrons n pouvant être échangés dans le dispositif (en mol). Qmax = n × NA × e, avec NA la constante d'Avogadro, et e = 1,6 × 10−19 C = 1eV, la charge électrique d'un électron.
Pour calculer ce nombre n, il faut prendre le nombre d'électrons échangés par réaction (en partant des deux demi-réactions utilisées pour l'écrire) et le multiplier par l'avancement maximal de la réaction.
On associe également à une pile la tension à ses bornes U = E − rI, avec E la force électromotrice reliée aux réactifs dans la pile et r sa résistance interne.
VI. Comment recharger une pile par électrolyse ?
Pour recharger une pile et la faire fonctionner de nouveau, il faut faire passer un courant à l'aide d'un générateur pour inverser le sens d'évolution de la réaction qui a lieu : c'est l'électrolyse. Cette évolution forcée n'est possible que parce qu'il y apport d'énergie de la part du générateur.Ainsi, dans une électrolyse, le générateur impose un changement de sens du courant et donc du mouvement des électrons :
• l'anode (pôle −) subit une réduction ;
• la cathode (pôle +) subit une oxydation.
Cette réaction étant forcée, elle éloigne le quotient de réaction de la constante d'équilibre. La quantité maximum d'électricité que le générateur peut apporter à la pile correspond à Qmax.
Remarque : les piles permettant l'électrolyse sont appelées « accumulateurs ».
Remarque : les piles permettant l'électrolyse sont appelées « accumulateurs ».
Zoom sur…
Les méthodes de stockage chimique
Les applications mettant en jeu les principes de conversion et de stockage de l'énergie chimique sont nombreuses, que ce soit dans la nature ou dans l'industrie. La liste suivante n'est pas exhaustive.• La photosynthèse chez les plantes est une forme d'électrolyse, où la lumière du soleil sert de source d'énergie. La respiration est, quant à elle, une réaction d'oxydoréduction spontanée.
 |
• Différents procédés électrolytiques du chlorure de sodium sont utilisés pour fabriquer du bicarbonate de soude ou de l'eau de javel, par exemple.
• Des méthodes d'électrolyse sont également utilisées pour purifier les métaux.
• Des batteries, en lithium notamment, sont utilisées dans plusieurs de nos appareils électroniques : téléphones portables, ordinateurs, tablettes, vélos et trottinettes électriques, voitures électriques, etc. La surexploitation de cette technologie a des conséquences. En effet, elle nécessite l'extraction de métaux rares, comme le lithium, ce qui cause des problèmes à la fois environnementaux et sociétaux.
© 2000-2026, Miscellane