Modéliser l'évolution temporelle d'un système, siège d'une transformation chimique
Les réactions chimiques peuvent se faire instantanément ou de façon plus lente ; elles peuvent même être cinétiquement bloquées. Une molécule est caractérisée par l'enchaînement des atomes qui la constituent, mais également par leur agencement tridimensionnel. Il existe un lien entre la géométrie d'une molécule et ses propriétés physico-chimiques et biologiques.
I. Comment caractériser la durée d'une réaction de façon qualitative ?
Qualitativement, on dit qu'une réaction est rapide lorsqu'elle se fait pendant un laps de temps trop court pour que l'on puisse suivre l'évolution à l'œil nu. À l'inverse, une réaction est dite lente lorsqu'on peut la suivre à l'œil nu. On peut aussi suivre une réaction lente avec des instruments de mesure : spectrophotomètre, conductimètre, capteur de pression, etc.
Notons qu'il existe des réactions infiniment lentes. C'est le cas lorsque l'évolution du système ne peut être appréciée, même après plusieurs jours : un tel système est dit cinétiquement inerte.
Notons qu'il existe des réactions infiniment lentes. C'est le cas lorsque l'évolution du système ne peut être appréciée, même après plusieurs jours : un tel système est dit cinétiquement inerte.
II. Comment caractériser la durée d'une réaction de façon quantitative ?
En plus de ces descriptions qualitatives, on peut caractériser quantitativement la vitesse de disparition d'un réactif ou d'apparition d'un produit. Pour cela, on peut utiliser la notion de vitesse volumique. Celle-ci correspond à la dérivée de la concentration d'un composé en fonction du temps. Soit, pour un composé quelconque A :
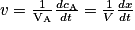 , avec :
, avec :
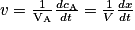 , avec :
, avec :• v, la vitesse volumique d'apparition/de disparition de A (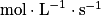 ) ;
) ;
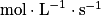 ) ;
) ;• cA(t), la concentration en A (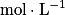 ) ;
) ;
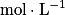 ) ;
) ;• x(t), l'avancement de la réaction (mol) et 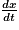 , la vitesse d'avancement (
, la vitesse d'avancement (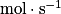 ) ;
) ;
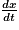 , la vitesse d'avancement (
, la vitesse d'avancement (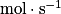 ) ;
) ;• V, le volume total du système étudié (L) ;
• VA, le coefficient stœchiométrique algébrique de A, qui provient de l'équation de réaction (sans unité). Il est pris positif lorsque A est un produit, et négatif lorsque A est un réactif.
On peut estimer cette vitesse volumique d'apparition/de disparition d'un composé à un instant t à partir de la courbe d'évolution de l'avancement en fonction du temps. Pour cela, on trace la tangente à la courbe au temps t, on calcule la pente de cette tangente qui correspond à 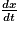 et on déduit de l'équation de réaction et du volume V du système la vitesse de réaction du composé voulu.
et on déduit de l'équation de réaction et du volume V du système la vitesse de réaction du composé voulu.
Le coefficient directeur de la tangente à la courbe de l'évolution de la concentration d'un composé en fonction du temps donne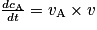 .
.
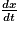 et on déduit de l'équation de réaction et du volume V du système la vitesse de réaction du composé voulu.
et on déduit de l'équation de réaction et du volume V du système la vitesse de réaction du composé voulu.Le coefficient directeur de la tangente à la courbe de l'évolution de la concentration d'un composé en fonction du temps donne
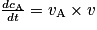 .
.III. Qu'est-ce qu'une loi de vitesse d'ordre 1 ?
On dit qu'une réaction est de premier ordre (ou qu'elle suit une loi de vitesse d'ordre 1) si la vitesse volumique de disparition d'un réactif est proportionnelle à sa concentration, soit pour un réactif A : v = k × cA, avec k une constante positive. Si on intègre cette équation, on obtient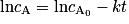 , avec
, avec 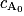 la concentration de A à t = 0.
la concentration de A à t = 0.Pour savoir si une réaction est de premier ordre, on peut donc tracer ln cA en fonction du temps. Si la courbe observée est une droite, la loi de vitesse de la réaction est d'ordre 1.
Remarque : cA étant proportionnelle à l'avancement x de la réaction, on peut également tracer lnx en fonction du temps.
IV. Comment mesurer le temps de demi-réaction ?
Le temps de demi-réaction est l'indicateur quantitatif de la durée d'une réaction chimique. Pour déterminer le temps de demi-réaction, on utilise la courbe de l'avancement de la réaction au cours du temps. Après avoir déterminé l'avancement final sur celle-ci, on divise par deux sa valeur. Puis on cherche l'abscisse du point correspondant.
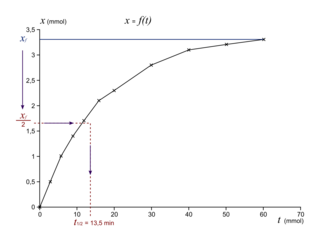 |
V. Qu'est-ce qu'un facteur cinétique ?
Les facteurs cinétiques sont les grandeurs qui peuvent influer sur la durée nécessaire pour atteindre l'état final, donc sur la vitesse d'une réaction chimique. Il existe de nombreux facteurs cinétiques, comme :
• la concentration des réactifs : plus la concentration des réactifs est grande, plus les molécules des réactifs ont tendance à se rencontrer, et donc plus la réaction est rapide ;
• la température du mélange réactionnel : plus la température du mélange réactionnel est grande, plus l'agitation thermique est importante, et plus la réaction est rapide ;
• la présence de certains solvants qui peut influer sur la vitesse de la réaction ;
• la surface de contact entre les réactifs : pour des réactifs solides, plus ils sont broyés finement et plus leur surface de contact est importante, et donc plus la réaction est rapide.
VI. Comment utiliser un catalyseur ?
D'un point de vue macroscopique, un catalyseur est une espèce chimique capable d'augmenter la vitesse d'une réaction thermodynamiquement possible. Si plusieurs réactions sont réalisables, il augmente la vitesse de réaction de manière sélective. Il n'intervient pas dans le bilan réactionnel : il agit à l'échelle microscopique comme un intermédiaire dans le mécanisme réactionnel et est toujours utilisé en faible quantité. Ainsi, la présence ou non d'un catalyseur est un facteur cinétique important. On distingue trois différents types de catalyse :
• la catalyse homogène : le catalyseur, les réactifs et les produits constituent un système monophasé (une seule phase) ;
• la catalyse hétérogène : le catalyseur est dans un état physique différent des réactifs de la réaction qu'il catalyse ;
• la catalyse enzymatique : certaines enzymes (c'est-à-dire certaines protéines) catalysent les réactions biologiques.
Zoom sur…
Les méthodes de suivi de la cinétique d'une réaction chimique
Pour suivre la cinétique d'une réaction, plusieurs méthodes de mesure peuvent être utilisées selon les propriétés des espèces en réaction :
• si l'une des espèces est colorée, on peut suivre sa concentration au cours du temps par la mesure de son absorbance (spectrophotométrie) ;
• si les concentrations des ions évolue au cours de la réaction, on peut les suivre par conductimétrie ;
• si l'une des espèces est gazeuse, on peut faire un suivi par mesure de la pression ;
• si les espèces sont organiques, on peut suivre la réaction par chromatographie ;
• on peut aussi faire un dosage colorimétrique ou pH-métrique du milieu réactionnel, à différents temps.
Exercice n°1
On suit l'évolution d'un réactif A dans une réaction de premier ordre. Quelles propositions sont vraies ?
Cochez la (ou les) bonne(s) réponse(s).
| ||
| ||
|
La réponse A correspond à la définition de la réaction de premier ordre. La réponse C correspond à une réécriture de la relation donnant l'évolution de la concentration 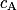 en fonction du temps :
en fonction du temps : 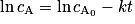 . La réponse B est fausse.
. La réponse B est fausse.
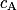 en fonction du temps :
en fonction du temps : 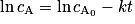 . La réponse B est fausse.
. La réponse B est fausse.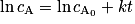 , avec k une constante positive et
, avec k une constante positive et 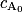 la concentration initiale en réactif A.
la concentration initiale en réactif A.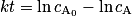 , avec k une constante positive et
, avec k une constante positive et 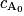 la concentration initiale en réactif A.
la concentration initiale en réactif A.
