Les réactions acido-basiques constituent une catégorie de transformations chimiques mettant en jeu le transfert d'un proton H+ entre un acide et une base. En solution aqueuse, ce sont les protons qui sont responsables du caractère acide, basique ou neutre du milieu, que le pH permet de mesurer. On distingue également les acides (ou bases) fort(e)s, qui réagissent totalement avec l'eau, et les acides (ou bases) faibles, qui ne réagissent que partiellement avec l'eau.
I. Qu'est-ce que le pH ?
Le pH d'une solution caractérise son acidité. On le définit par la relation : pH = −log[H3O+], [H3O+] représentant la concentration en ions H3O+ en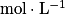 . Le pH n'a pas d'unité.
. Le pH n'a pas d'unité.À 25 °C, une solution aqueuse est dite :
• neutre si son pH est égal à 7 ![\left ( \left [ \mathrm{H}_{3}\mathrm{O}^{+} \right ]= 10^{-7}\: \mathrm{mol}\cdot \mathrm{L}^{-1} \right )](https://static1.assistancescolaire.com/t/images/t_speph_01_m2.png) ;
;
![\left ( \left [ \mathrm{H}_{3}\mathrm{O}^{+} \right ]= 10^{-7}\: \mathrm{mol}\cdot \mathrm{L}^{-1} \right )](https://static1.assistancescolaire.com/t/images/t_speph_01_m2.png) ;
;• acide si son pH est inférieur à 7 ![\left ( \left [ \mathrm{H}_{3}\mathrm{O}^{+} \right ]> 10^{-7}\: \mathrm{mol}\cdot \mathrm{L}^{-1} \right )](https://static1.assistancescolaire.com/t/images/t_speph_01_m3.png) ;
;
![\left ( \left [ \mathrm{H}_{3}\mathrm{O}^{+} \right ]> 10^{-7}\: \mathrm{mol}\cdot \mathrm{L}^{-1} \right )](https://static1.assistancescolaire.com/t/images/t_speph_01_m3.png) ;
;• basique si son pH est supérieur à 7 ![\left ( \left [ \mathrm{H}_{3}\mathrm{O}^{+} \right ]< 10^{-7}\: \mathrm{mol}\cdot \mathrm{L}^{-1} \right )](https://static1.assistancescolaire.com/t/images/t_speph_01_m4.png) .
.
![\left ( \left [ \mathrm{H}_{3}\mathrm{O}^{+} \right ]< 10^{-7}\: \mathrm{mol}\cdot \mathrm{L}^{-1} \right )](https://static1.assistancescolaire.com/t/images/t_speph_01_m4.png) .
.Une solution est d'autant plus acide que son pH est petit, et d'autant plus basique que son pH est grand.
Plusieurs méthodes permettent de mesurer le pH d'une solution. On retiendra notamment :
Plusieurs méthodes permettent de mesurer le pH d'une solution. On retiendra notamment :
• les indicateurs colorés et le papier pH, dont la couleur dépend du pH de la solution. Ce sont des méthodes rapides mais peu précises ;
• le pH-mètre, qui utilise le caractère chargé des ions H3O+ pour offrir plus de précision.
II. Comment caractériser une réaction acido-basique ?
Une réaction acido-basique est une réaction entre l'acide d'un premier couple acide-base et la base d'un second couple. Pour écrire l'équation de réaction, on part des deux demi-équations caractérisant chaque couple :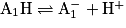
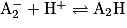
On les combine ensuite en faisant disparaître les protons H+. On obtient alors l'équation de réaction suivante :
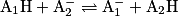 .
.III. Qu'est-ce qu'un acide fort ou une base forte ?
Un acide fort est un acide qui réagit totalement avec l'eau pour donner des ions H3O+. On notera sa réaction avec une flèche simple (→). On en déduit que le pH d'une solution d'acide fort, de concentration C (en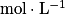 ), vaut pH = −logC.
), vaut pH = −logC.Une base forte est une base qui réagit totalement avec l'eau pour donner des ions HO−. On notera sa réaction avec une flèche simple (→). Le pH d'une solution de base forte, de concentration C (en
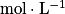 ), vaut pH = 14 + logC.
), vaut pH = 14 + logC.La réaction d'un acide fort avec une base forte est une réaction totale, d'équation :
H3O+ + HO−→H2O.
Les ions apportés par l'acide et la base ne participent pas à la réaction : ce sont des ions indifférents ou spectateurs. Cette réaction s'accompagne d'une élévation thermique : elle est exothermique. Lorsque les réactifs sont introduits en proportions stœchiométriques, alors le pH de la solution finale est égal à 7.
Exercice n°1
IV. Qu'est-ce que l'autoprotolyse et le produit ionique de l'eau ?
L'eau peut jouer le rôle à la fois d'un acide et d'une base. Deux molécules d'eau vont donc pouvoir réagir ensemble, l'une en tant qu'acide, l'autre en tant que base. C'est l'autoprotolyse de l'eau :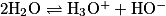 .
.On associe cette réaction à une constante, le produit ionique de l'eau Ke = [H3O+] × [HO−]. C'est une grandeur sans unité qui est constante à température fixée.
On utilise aussi pKe = −logKe.
À 25 °C, Ke = 10−14 et pKe = 14.
V. Qu'est-ce qu'une constante d'acidité et un domaine de prédominance ?
Lorsque l'acide AH et la base A− d'un couple sont faibles, ils donnent une réaction partielle avec l'eau :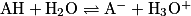 .
.On peut définir une constante pour cet équilibre, notée KA et appelée constante d'acidité :
![\mathrm{K}_{\mathrm{A}}= \frac{\left [ \mathrm{A}^{-} \right ]\left [ \mathrm{H}_{3}\mathrm{O}^{+} \right ]}{\left [ \mathrm{AH} \right ]}](https://static1.assistancescolaire.com/t/images/t_speph_01_m12.png) , où [A−], [H3O+] et [AH] sont les concentrations des différentes espèces en solution, à l'équilibre, en
, où [A−], [H3O+] et [AH] sont les concentrations des différentes espèces en solution, à l'équilibre, en 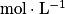 .
.Le pKA d'un couple acide-base est défini par la relation suivante : pKA = −logKA. Il permet de déterminer la force d'un acide. Plus l'acide est fort, plus le pKA est faible. Avec la relation précédente, on peut montrer que :
![\mathrm{pH}= \mathrm{pK}_{\mathrm{A}}+\mathrm{log}\frac{\left [ \mathrm{A}^{-} \right ]}{\left [ AH \right ]}](https://static1.assistancescolaire.com/t/images/t_speph_01_m14.png) :
:• si pH < pKA, l'acide AH est l'espèce prédominante ;
• si pH > pKA, la base A− est l'espèce prédominante ;
• si pH = pKA, l'acide et sa base conjuguée ont même concentration.
Le diagramme de prédominance indique les domaines de prédominance en fonction du pH.
VI. Qu'est-ce qu'un titrage acido-basique ?
Titrer une espèce chimique A (solution titrée) de concentration inconnue consiste à introduire progressivement, à l'aide d'une burette, une solution B (la solution titrante) avec laquelle l'espèce A réagit totalement et rapidement.L'équivalence est atteinte lorsque les réactifs A et B sont en proportions stœchiométriques. On pourra alors écrire : nA = nB si les nombres stœchiométriques devant les réactifs A et B sont les mêmes. On aura alors : CA × VA = CB × VB,éq, avec :
• CA et CB les concentrations des espèces A et B ;
• VA, le volume de la solution A introduite
• VB,éq le volume de solution B introduit à l'équivalence.
Zoom sur…
La solution tampon
Un mélange équimolaire d'un acide et de sa base conjuguée constitue une solution tampon. Son pH, égal au pKA du couple, est peu sensible à un ajout d'eau, ou à l'ajout modéré d'un acide ou d'une base forte. De nombreux milieux biologiques sont tamponnés, car les réactions qui s'y déroulent sont catalysées par des enzymes qui sont très sensibles au pH.Le pKA d'un couple acide/base peut se déterminer sur la courbe de titrage. Il correspond à l'ordonnée du point qui a pour abscisse la valeur du volume à l'équivalence divisée par deux :
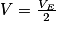 . Ce point est appelé la demi-équivalence.
. Ce point est appelé la demi-équivalence.Lors d'un titrage acido-basique, le volume à l'équivalence peut être déterminé par :
• la méthode des doubles tangentes ;
• la méthode de la dérivée (réalisée avec un ordinateur) ;
• la méthode colorimétrique (introduction d'un indicateur coloré).
Exercice n°1
On dissout dans 0,5 L d'eau 1,2×10−3mol d'acide acétylsalicylique. Le pH de la solution obtenue est 3,1.
Cochez la (ou les) bonne(s) réponse(s).
| ||
| ||
| ||
|
L'acide acétylsalicylique est un acide, il peut donc libérer un proton H+. SI l'acide acide acétylsalicylique était un acide fort, le pH de la solution serait pH=2,6. Or le pH mesuré est supérieur, la réaction de l'acide acétylsalicylique avec l'eau n'est donc pas totale, il s'agit d'un acide faible.

