L'atmosphère terrestre et la vie
Fiche
L'atmosphère de notre planète est très particulière car elle est très riche en dioxygène (O2). La présence de ce gaz en de telles quantités est le fruit d'une longue histoire, débutée il y a des milliards d'années, et étroitement liée à la présence de vie sur Terre. C'est cette histoire que la première partie de ce cours présente. Il s'attarde ensuite sur une conséquence majeure de la présence d'O2, l'existence de la couche d'ozone. Enfin, la dernière partie de ce cours porte sur une autre particularité de l'atmosphère terrestre, liée à la précédente, sa teneur en dioxyde de carbone (CO2) et le rôle que la vie a joué et joue encore sur elle, via ce qu'on appelle le cycle du carbone.
De l'atmosphère primitive à l'atmosphère actuelle
L'atmosphère terrestre actuelle est très différente de ce qu'elle était initialement. En effet, peu après sa formation il y a 4,57 milliards d'années (ou Giga-années, Ga), l'atmosphère dite primitive devait être très dense et essentiellement composée de vapeur d'eau (H2O à l'état gazeux), de CO2, et de diazote (N2). Pourtant, aujourd'hui, notre atmosphère est composée essentiellement de N2 et d'O2, respectivement à hauteur de 78 % et 21 %. Et le CO2 ne représente actuellement que 0,03 % des gaz atmosphériques.
La Terre primitive a fortement refroidi après sa formation. La vapeur d'eau s'est alors condensée en eau liquide qui a formé les premiers océans terrestres. Une partie du CO2 atmosphérique s'est alors solubilisée dans ces océans et, à la suite d'une série de réactions chimiques que nous ne détaillerons pas ici, s'est retrouvée piégée sous forme de roches carbonatées comme le calcaire. L'atmosphère est donc devenue beaucoup moins dense : elle ne contenait plus beaucoup de vapeur d'eau et n'était plus constituée que de CO2 et de N2.
Or, c'est à cette période, il y a environ 4 Ga, que la vie est sans doute apparue dans les océans sous forme de micro-organismes de type bactérie. Certaines de ces bactéries, les cyanobactéries, réalisent la photosynthèse et ont formé des structures en forme de chou-fleur composées de nombreuses couches très fines de calcaire, les stromatolithes, dont les plus anciens spécimens connus ont un âge estimé à 3,5 Ga environ.
La Terre primitive a fortement refroidi après sa formation. La vapeur d'eau s'est alors condensée en eau liquide qui a formé les premiers océans terrestres. Une partie du CO2 atmosphérique s'est alors solubilisée dans ces océans et, à la suite d'une série de réactions chimiques que nous ne détaillerons pas ici, s'est retrouvée piégée sous forme de roches carbonatées comme le calcaire. L'atmosphère est donc devenue beaucoup moins dense : elle ne contenait plus beaucoup de vapeur d'eau et n'était plus constituée que de CO2 et de N2.
Or, c'est à cette période, il y a environ 4 Ga, que la vie est sans doute apparue dans les océans sous forme de micro-organismes de type bactérie. Certaines de ces bactéries, les cyanobactéries, réalisent la photosynthèse et ont formé des structures en forme de chou-fleur composées de nombreuses couches très fines de calcaire, les stromatolithes, dont les plus anciens spécimens connus ont un âge estimé à 3,5 Ga environ.
 Figure 1. Fragment de stromatolithe australien très ancien, daté de 3,4 Ga. |
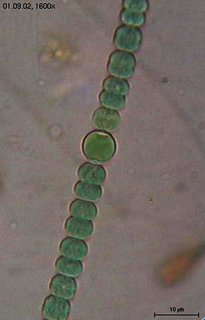 Figure 2. Filament de cyanobactéries actuelles, semblable à ceux pouvant être à l'origine de la formation de stromatolithes, aujourd'hui encore. |
La photosynthèse pratiquée à partir de ce moment par les êtres vivants s'est mise à consommer du CO2 et à produire de l'O2. En effet, son équation bilan est la suivante :
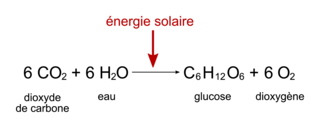 Figure 3. Équation bilan de la photosynthèse. |
La teneur en CO2 atmosphérique s'est donc mise à diminuer et ce gaz a fini par ne plus être présent en grande quantité dans l'atmosphère. Cela ne signifie pas que son rôle est devenu insignifiant pour autant, comme on le verra dans d'autres chapitres.
La teneur en O2 n'a pas immédiatement augmenté dans l'atmosphère à la suite de sa production par photosynthèse. En effet, dans un premier temps, jusqu'à il y a environ −2,4 Ga, cet O2 a oxydé des espèces chimiques comme des ions fer, présents dans les océans, ce qui a entraîné la formation de roches comme les fers rubanés qui constituent à l'heure actuelle les principaux gisements de minerai de fer exploités. Puis, à partir de −2,4 Ga, toutes ces espèces chimiques réductrices ayant été oxydées, l'O2 a commencé à s'accumuler dans l'atmosphère jusqu'à en constituer environ 21 %.
Aujourd'hui, la teneur atmosphérique en O2 est globalement stable. En effet, sa production par les êtres vivants photosynthétiques (on parle de sources d'O2) est globalement compensée par la respiration de ces mêmes êtres vivants, ainsi que les êtres vivants non photosynthétiques, qui en consomment (on parle de puits d'O2).
Quant au N2, sa quantité globale dans l'atmosphère n'a presque pas varié au cours des temps géologiques, ce gaz étant extrêmement peu réactif. En revanche, l'atmosphère étant devenue beaucoup moins riche en gaz qu'elle ne l'était initialement (l'essentiel de la vapeur d'eau et du dioxyde de carbone présents à l'origine ont quitté l'atmosphère), il est devenu en proportion majoritaire.
La teneur en O2 n'a pas immédiatement augmenté dans l'atmosphère à la suite de sa production par photosynthèse. En effet, dans un premier temps, jusqu'à il y a environ −2,4 Ga, cet O2 a oxydé des espèces chimiques comme des ions fer, présents dans les océans, ce qui a entraîné la formation de roches comme les fers rubanés qui constituent à l'heure actuelle les principaux gisements de minerai de fer exploités. Puis, à partir de −2,4 Ga, toutes ces espèces chimiques réductrices ayant été oxydées, l'O2 a commencé à s'accumuler dans l'atmosphère jusqu'à en constituer environ 21 %.
Aujourd'hui, la teneur atmosphérique en O2 est globalement stable. En effet, sa production par les êtres vivants photosynthétiques (on parle de sources d'O2) est globalement compensée par la respiration de ces mêmes êtres vivants, ainsi que les êtres vivants non photosynthétiques, qui en consomment (on parle de puits d'O2).
Quant au N2, sa quantité globale dans l'atmosphère n'a presque pas varié au cours des temps géologiques, ce gaz étant extrêmement peu réactif. En revanche, l'atmosphère étant devenue beaucoup moins riche en gaz qu'elle ne l'était initialement (l'essentiel de la vapeur d'eau et du dioxyde de carbone présents à l'origine ont quitté l'atmosphère), il est devenu en proportion majoritaire.
La couche d'ozone
L'existence d'une haute teneur en O2 dans l'atmosphère a pour conséquence la formation naturelle d'un autre gaz, l'ozone (O3). En effet, le rayonnement solaire, et plus spécifiquement les plus énergétiques de ses rayons ultraviolets (les UV-C), dissocient certaines molécules d'O2 en 2 atomes d'oxygène. C'est ce que l'on appelle une photodissociation. Chacun de ces atomes d'oxygène, très instable isolément, réagit avec une autre molécule d'O2 pour former une molécule d'ozone O3.
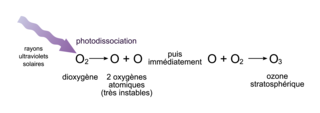 Figure 4. La formation de l'ozone dans la stratosphère. |
Ce phénomène a lieu essentiellement entre 20 et 40 km d'altitude, dans la couche de l'atmosphère appelée la stratosphère. Il est à l'origine de la formation de ce que l'on appelle la couche d'ozone. Attention toutefois à ce terme qui fait imaginer une couche massive d'ozone pur située en altitude. En réalité, il s'agit d'une zone de l'atmosphère enrichie en ozone sans que celui-ci soit pour autant un composant majoritaire.
Néanmoins, cet ozone stratosphérique absorbe, lui aussi par photodissociation, une grosse partie des rayonnements ultraviolets du rayonnement solaire (le reste des UV-C, quasiment tous les UV-B et une partie des UV-A). La couche d'ozone absorbant les plus dangereux des rayons UV, elle en protège donc les êtres vivants. Après sa photodissociation, l'ozone stratosphérique redonne un O2 et un oxygène atomique pouvant réagir pour reformer soit de l'O2, soit à nouveau de l'O3. L'ozone est donc en permanence créé et détruit dans la stratosphère.
Néanmoins, cet ozone stratosphérique absorbe, lui aussi par photodissociation, une grosse partie des rayonnements ultraviolets du rayonnement solaire (le reste des UV-C, quasiment tous les UV-B et une partie des UV-A). La couche d'ozone absorbant les plus dangereux des rayons UV, elle en protège donc les êtres vivants. Après sa photodissociation, l'ozone stratosphérique redonne un O2 et un oxygène atomique pouvant réagir pour reformer soit de l'O2, soit à nouveau de l'O3. L'ozone est donc en permanence créé et détruit dans la stratosphère.
CO2 atmosphérique et cycle du carbone
À l'heure actuelle, le CO2 ne constitue plus que 0,03 % des gaz atmosphériques. Cependant, ce n'est pas parce que sa teneur est faible dans l'atmosphère qu'il ne joue pas un rôle important. Nous allons examiner les échanges qui ont lieu entre l'atmosphère et les autres enveloppes de la Terre et qui aboutissent à faire varier la concentration de CO2 atmosphérique. L'ensemble de ces échanges constitue ce que l'on appelle le cycle du carbone. Attention : on parle bien de cycle du carbone et pas de cycle du CO2, parce que le CO2 atmosphérique peut être transformé en d'autres espèces chimiques carbonées à la suite de son passage dans une autre enveloppe terrestre.
Voici une représentation simplifiée de ce cycle, valable à notre échelle de temps humaine et pas géologique. Les chiffres sont donnés en Gigatonnes (Gt, soit un milliard de tonnes) de carbone. Il est important de se rendre compte qu'il s'agit d'estimations et il faut comparer les ordres de grandeur des chiffres plus que les chiffres eux-mêmes.
Voici une représentation simplifiée de ce cycle, valable à notre échelle de temps humaine et pas géologique. Les chiffres sont donnés en Gigatonnes (Gt, soit un milliard de tonnes) de carbone. Il est important de se rendre compte qu'il s'agit d'estimations et il faut comparer les ordres de grandeur des chiffres plus que les chiffres eux-mêmes.
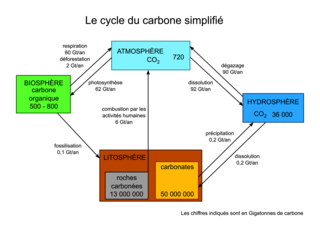 Figure 5. Le cycle du carbone. |
De manière très résumée, on peut dire que du carbone est échangé entre l'atmosphère et trois réservoirs principaux : les êtres vivants (la biosphère), les océans (l'hydrosphère) et certaines roches (présentes dans la lithosphère) qui constituent le gros du stock de carbone. Les échanges (ou flux) sont grossièrement à l'équilibre entre la majorité des réservoirs, les phénomènes retirant ou injectant du CO2 dans l'atmosphère se compensant approximativement.
Cependant, il existe une exception majeure : à l'heure actuelle, le flux de carbone est beaucoup plus important depuis le réservoir des roches carbonées (gaz naturel, pétrole et charbon) vers l'atmosphère que dans le sens inverse. En effet, ces roches constituent nos principales sources d'énergie aujourd'hui. Et nous en utilisons bien plus que la quantité qui se renouvelle naturellement. Cela signifie d'une part que ces sources d'énergies sont non renouvelables à notre échelle de temps humaine (et qu'il faudra bien utiliser autre chose quand il n'y en aura plus), et d'autre part que nous sommes en train d'injecter dans l'atmosphère de grandes quantités de CO2, originellement prisonnier de la lithosphère sous une autre forme. Les conséquences de ce phénomène seront
Cependant, il existe une exception majeure : à l'heure actuelle, le flux de carbone est beaucoup plus important depuis le réservoir des roches carbonées (gaz naturel, pétrole et charbon) vers l'atmosphère que dans le sens inverse. En effet, ces roches constituent nos principales sources d'énergie aujourd'hui. Et nous en utilisons bien plus que la quantité qui se renouvelle naturellement. Cela signifie d'une part que ces sources d'énergies sont non renouvelables à notre échelle de temps humaine (et qu'il faudra bien utiliser autre chose quand il n'y en aura plus), et d'autre part que nous sommes en train d'injecter dans l'atmosphère de grandes quantités de CO2, originellement prisonnier de la lithosphère sous une autre forme. Les conséquences de ce phénomène seront
Zoom sur…
Rayons UV, ADN et couche d'ozone
Les rayons ultraviolets (UV) sont un type de rayonnement électromagnétique. Leur longueur d'onde est comprise entre 400 et 100 nm, ce qui les place dans le spectre des rayonnements électromagnétiques entre la lumière visible et les rayons X. Du fait de leur faible longueur d'onde, ce sont des rayonnements assez énergétiques et ils peuvent endommager les molécules qu'ils rencontrent comme l'ADN des êtres vivants. Le plus souvent, les rayons UV causent des mutations à l'ADN en soudant deux bases azotées thymine ensemble, formant ce qu'on appelle un dimère de thymine. Les mutations de l'ADN peuvent causer des malformations embryonnaires, des cancers ou même tuer les cellules touchées si elles sont trop nombreuses. Plus la longueur d'onde des UV est faible, plus ils sont énergétiques et plus ils sont dangereux. On distingue donc trois catégories d'UV : les UV-A (longueur d'onde 315 à 400 nm) qui sont les moins dangereux mais quand même cancérigènes, les UV-B (280 à 315 nm) dangereux et les UV-C (100 à 280 nm) très dangereux. Seuls les UV-A et les moins énergétiques des UV-B du rayonnement solaire parviennent jusqu'à la surface de notre planète, les plus dangereux des UV-B et les UV-C étant absorbés par l'atmosphère et notamment par la couche d'ozone. C'est ce qui rend la vie terrestre possible ! C'est pour cette raison qu'un accord international (le protocole de Montréal) a été conclu pour limiter voire éliminer la production de certains gaz (notamment certains appelés les CFC) dégradant la couche d'ozone (ce qu'on a appelé le « trou de la couche d'ozone »). Il s'agit à l'heure actuelle du principal accord international environnemental qui a réellement été couronné de succès, le taux atmosphérique des gaz destructeurs d'ozone ayant fortement diminué et la couche d'ozone elle-même semblant en voie de se reconstituer.© 2000-2026, Miscellane