La solidification de l'eau
Fiche
Réponse : en se mélangeant à l'eau, le sel modifie les propriétés de celle-ci et abaisse sa température de solidification. Voyons comment évoluent les températures de l'eau pure et des mélanges lors de la solidification.
I. Mesurer une température de solidification
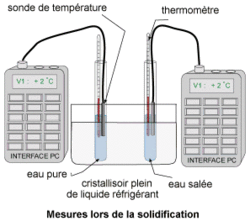 |
Pour mesurer la température au cours de la solidification de l'eau pure et de l'eau salée, il faut placer ces deux liquides dans un milieu qui va les refroidir (à environ –10°C).
• Protocole : on utilise deux tubes à essai dont l'un est rempli d'eau pure (eau déminéralisée) et l'autre d'eau salée. Ils sont refroidis dans un mélange réfrigérant. La température est mesurée toutes les 30 secondes à la main et une interface de mesure couplée à un ordinateur effectue la même mesure toutes les secondes.
Le mélange réfrigérant est obtenu en mélangeant de l'eau avec beaucoup de sel (solution saturée) et en plaçant cette solution dans le bac à glaçons d'un réfrigérateur durant quelques heures. L'interface de mesure par ordinateur est constituée d'une sonde métallique qui plonge dans le liquide dont on veut mesurer la température. Cette sonde convertit la température en un signal électrique transmis par un fil à l'ordinateur qui se charge de convertir ce signal électrique en valeur de température, avant d'enregistrer cette valeur. La rapidité de la mesure permet à l'interface d'effectuer plusieurs mesures par seconde, mais pour cette expérience, une seule mesure par seconde est suffisante.
• Observation : au cours de l'expérience, on observe que la température de l'eau pure semble se stabiliser un moment autour de 0°C. À cette température, on peut observer la formation de cristaux de glace dans l'eau : on a donc à la fois de l'eau liquide et de l'eau solide. En dessous de 0°C, il n'y a plus que de la glace dans le tube à essai qui contenait l'eau pure. Pour l'eau salée, la température ne se stabilise pas et le mélange est toujours liquide en fin d'expérience.
II. Tracer un graphique
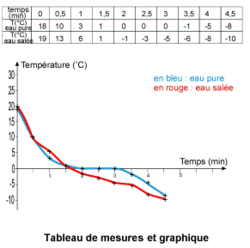 |
• Pour exploiter les mesures que nous avons faites, nous allons les utiliser pour tracer un graphique sur une feuille de papier millimétrée. Commençons par tracer deux axes : l'axe des abscisses, horizontal, représente l'axe du temps ; l'axe des ordonnées, vertical, est placé à l'extrême gauche de la feuille et représente l'axe des températures. Chaque centimètre sur l'axe du temps représente 30 secondes et sur l'axe des températures, 1°C. Nous plaçons le zéro de cette échelle de façon à pouvoir placer des températures négatives.
• Chaque mesure du tableau est alors placée en suivant d'abord l'axe des temps en abscisses puis en remontant (température positive) ou en descendant (température négative) verticalement pour placer une croix horizontale en regard de la température à cet instant de mesure. Une fois tous les points placés, on les relie à main levée de manière à former une courbe.
III. La solidification d'un corps pur et d'un mélange
• On remarque que la courbe de solidification de l'eau pure forme un palier à 0°C. C'est à cette température que s'effectue le changement d'état de l'eau liquide en eau solide. Pour tous les corps purs, il existe de la même façon un palier lors du changement d'état et la température à laquelle se produit ce palier est caractéristique d'un corps pur donné.
• Pour un mélange d'eau et de sel, par contre, il n'y a pas de palier car c'est un mélange. Les mélanges n'ont pas de paliers de changement d'état. C'est d'ailleurs un bon moyen de mettre en évidence un mélange.
iV. Température, chaleur et changement d'état
• Au début de l'expérience précédente, l'eau liquide perd de l'énergie sous forme de chaleur, ce qui provoque une baisse de la température.
• Quand l'eau commence à se solidifier à la température de 0° C, l'énergie perdue n'entraîne pas une diminution de la température, mais permet le passage de l'état liquide à l'état solide. Lorsque la solidification est terminée, la perte d'énergie entraîne une nouvelle baisse de température, jusqu'à l'équilibre thermique.
© 2000-2026, Miscellane