Réponse : Lavoisier, chimiste français de la fin du xviiie siècle a effectué des expériences de combustion de soufre et de phosphore dans l'air. À l'aide d'une balance, il a constaté que la masse des produits était plus grande que la masse des réactifs de départ, mais aussi que la masse « gagnée » était « perdue » par l'air ! Le principe de la conservation de la matière était né !
I. Réaction entre le calcaire et l'acide chlorhydrique
Réalisons une expérience pour interpréter cette réaction chimique.
• Protocole : mettons un peu de poudre de craie (essentiellement constituée de calcaire de formule CaCO3) dans une bouteille en plastique, placée sur une balance. Ajoutons 50 ml d'acide chlorhydrique (HCl) dilué et fermons la bouteille rapidement. La balance indique alors une masse de 55,3 g.
• Observation : de petites bulles de gaz apparaissent à la surface du morceau de craie, il y a un dégagement de gaz. La taille du morceau de craie diminue, du calcaire disparaît. En fin de réaction, la craie a disparu. La balance indique une masse de 55,3 g.
• Pendant toute la réaction, la masse de la bouteille n'a pas varié. La diminution de la masse des réactifs est donc égale à la masse des produits formés après la réaction. On dit que la masse a été conservée. Ce résultat est valable pour toute réaction chimique.
II. Les équations de réaction
• Revenons sur la combustion du carbone dans le dioxygène :
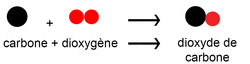 |
On utilise les formules des molécules des réactifs et des produits pour écrire l'équation de la réaction chimique.
Le sens de la flèche indique le sens de la transformation.
C + O2 → CO2
On « lit » :
Un atome de carbone réagit avec une molécule de dioxygène pour former une molécule de dioxyde de carbone.
À gauche, on compte un atome de carbone et deux atomes d'oxygène. À droite, il y a le même nombre d'atomes, un de carbone et deux d'oxygène.
Le sens de la flèche indique le sens de la transformation.
C + O2 → CO2
On « lit » :
Un atome de carbone réagit avec une molécule de dioxygène pour former une molécule de dioxyde de carbone.
À gauche, on compte un atome de carbone et deux atomes d'oxygène. À droite, il y a le même nombre d'atomes, un de carbone et deux d'oxygène.
• Le nombre d'atomes de chaque sorte est conservé ; les atomes des réactifs se réarrangent pour former les nouvelles molécules des produits. La masse totale est conservée comme l'expérience décrite plus haut l'a montré. Ceci est général pour les réactions chimiques.
III. Combustion d'hydrocarbures
• Le méthane brûle dans le dioxygène pour donner du dioxyde de carbone et de l'eau.
Méthane + dioxygène → dioxyde de carbone + eau
Méthane + dioxygène → dioxyde de carbone + eau
• Remplaçons les noms des réactifs et des produits par leurs formules :
CH4 + O2 → CO2 + H2O
CH4 + O2 → CO2 + H2O
• Nous remarquons que les nombres d'atomes d'oxygène et d'hydrogène sont différents à gauche et à droite. On doit « ajuster » l'équation pour que le nombre d'atomes de chaque sorte soit conservé.
CH4 + O2 → CO2 + 2 H2O
CH4 + O2 → CO2 + 2 H2O
• Comptons maintenant les atomes d'oxygène, à gauche, la molécule de dioxygène possède 2 atomes ; à droite, la molécule de dioxyde de carbone en possède 2 et les deux molécules d'eau en contiennent 2, au total à droite, il y a 4 atomes d'oxygène. Nous mettrons donc un coefficient 2 devant O2 à gauche.
CH4 + 2 O2 → CO2 + 2 H2O
CH4 + 2 O2 → CO2 + 2 H2O
• On lit ainsi :
Une molécule de méthane réagit avec deux molécules de dioxygène pour former une molécule de dioxyde de carbone et deux molécules d'eau.
Remarque, on ne fait pas figurer le coefficient 1 devant la formule de la molécule.
Le nombre d'atomes de chaque sorte est ainsi conservé, l'équation de la réaction est ajustée ou équilibrée.
Une molécule de méthane réagit avec deux molécules de dioxygène pour former une molécule de dioxyde de carbone et deux molécules d'eau.
Remarque, on ne fait pas figurer le coefficient 1 devant la formule de la molécule.
Le nombre d'atomes de chaque sorte est ainsi conservé, l'équation de la réaction est ajustée ou équilibrée.
• De même que le méthane, le butane de formule C4H10 brûle dans le dioxygène pour donner du dioxyde de carbone et de l'eau.
Dans une première étape, remplaçons les noms des réactifs et des produits par leur formule :
C4H10 + O2 → CO2 + 2 H2O
Pour assurer la conservation du nombre d'atomes de carbone, d'oxygène, et d'hydrogène, il faut mettre les coefficients convenables devant les formules des molécules et des produits :
2 C4H10 + 13 O2 → 8 CO2 + 10 H2O
On retiendra les coefficients entiers les plus faibles.
Dans une première étape, remplaçons les noms des réactifs et des produits par leur formule :
C4H10 + O2 → CO2 + 2 H2O
Pour assurer la conservation du nombre d'atomes de carbone, d'oxygène, et d'hydrogène, il faut mettre les coefficients convenables devant les formules des molécules et des produits :
2 C4H10 + 13 O2 → 8 CO2 + 10 H2O
On retiendra les coefficients entiers les plus faibles.
• En conclusion : une transformation chimique est modélisée par une équation de la réaction. À gauche figurent les formules des molécules des réactifs, à droite celles des produits formés. Le sens de la flèche indique le sens de la transformation. Les coefficients placés devant les formules des réactifs et des produits permettent d'ajuster l'équation, c'est-à-dire d'assurer la conservation du nombre d'atomes de chaque sorte. Au cours d'une transformation chimique, il y a conservation de la matière, les atomes sont conservés et, en conséquence, la masse reste constante.
Exercice n°1
Au cours d'une transformation chimique :
Cochez la (ou les) bonne(s) réponse(s).
| ||
| ||
|
Les atomes des molécules des réactifs s'assemblent pour donner de nouvelles molécules. Il n'apparaît pas de nouvelles espèces d'atomes et le nombre total d'atomes est conservé.
Exercice n°2
L'équation de la combustion du méthane dans le dioxygène s'écrit : CH4+ 2 O2→ CO2 + 2H2O.
Cochez la (ou les) bonne(s) réponse(s).
| ||
| ||
| ||
|
On lit « une molécule de méthane réagit avec deux molécules de dioxygène pour donner une molécule de dioxyde de carbone et deux molécules d'eau ». Le nombre d'atomes de chaque espèce est conservé au cours de la transformation chimique.
Exercice n°3
Complète les phrases.
Écrivez les réponses dans les zones colorées.
Au cours d'une transformation chimique, il y a de la masse.
La masse des produits obtenus est égale à la de la masse des réactifs.
Lorsqu'on écrit l'équation d'une transformation chimique, pour que le nombre d'atomes de chaque sorte soit , il faut mettre, devant les formules des réactifs et des produits, des convenables : l'équation est alors .
La masse des produits obtenus est égale à la de la masse des réactifs.
Lorsqu'on écrit l'équation d'une transformation chimique, pour que le nombre d'atomes de chaque sorte soit , il faut mettre, devant les formules des réactifs et des produits, des convenables : l'équation est alors .
Au cours d'une transformation chimique, il y a toujours conservation de la masse et conservation du nombre d'atomes de chaque espèce. Il faut donc ajuster une équation chimique.
Exercice n°4
La combustion complète du propane dans le dioxygène donne du dioxyde de carbone et de l'eau. La formule du propane est C3H8.
1. La molécule de propane contient 3 atomes de carbone et 8 atomes d'hydrogène.
Cochez la bonne réponse.
| ||
|
2. Ajuste l'équation de la combustion du propane dans le dioxygène en plaçant les coefficients convenables devant les molécules des réactifs et des produits. Procède par étapes.
Écrivez les réponses dans les zones colorées.
a) Ajuste le nombre d'atomes de carbone : C3H8 + O2→ CO2 + H2O.
b) Ajuste le nombre d'atomes d'hydrogène : C3H8 + O2→ 3 CO2+ H2O.
c) Ajuste le nombre d'atomes d'oxygène : C3H8 + O2→ 3 CO2 + 4 H2O.
1. L'indice à droite du symbole de l'élément indique le nombre d'atomes dans la molécule.

