La molécule : un modèle pour la matière
Fiche
Réponse : tous les corps sont constitués de particules ; pour les gaz et de nombreux autres corps comme l'eau ou le sucre, il s'agit de molécules.
I. Petite histoire des particules
• Démocrite (460-370 av. J.-C), philosophe de l'Antiquité grecque, imagine que la matière est composée de minuscules particules indivisibles. Pour lui, les différents états de la matière sont dus aux transformations de la surface de ces particules qui peuvent être lisses ou crochues.
• Aristote (384-322 av. J.-C) lui, défend l'idée que la matière comprend quatre éléments : l'eau, l'air, le feu et la terre auxquels sera ajouté plus tard l'éther qui constitue l'espace autour de la Terre. Pour Aristote, le vide n'existe pas et la matière est divisible à l'infini : il n'y a donc pas de particules indivisibles.
• Ce n'est qu'au cours du xviie siècle que l'astronome et philosophe français Gassendi (1592-1655) reprend la théorie de Démocrite. Cette dernière sera ensuite sans cesse améliorée jusqu'à aujourd'hui. On découvrira, en particulier, que les différents états de la matière ne sont pas dus aux transformations de la surface des particules mais aux variations de leur comportement selon la température.
II. Les gaz sont constitués de molécules
1. Les gaz sont constitués de molécules
• Revenons sur les propriétés des gaz. Que se passe-t-il lorsque l'on appuie avec le doigt sur le piston de la seringue bouchée, dans laquelle de l'air est emprisonné ? Le volume de l'air diminue, les particules d'air se rapprochent les unes des autres. Ces particules sont des molécules de diazote et de dioxygène.
• Le modèle moléculaire permet de comprendre la compression des gaz et aussi leur caractère expansible, si l'on tire le piston de la seringue, les molécules s'éloignent les unes des autres et occupent un volume plus grand.
2. Corps purs et mélanges
• Un gaz est constitué de molécules. Les molécules de dioxygène ou de diazote sont identiques entre elles. Le diazote et le dioxygène sont des corps purs, les molécules qui les constituent sont toutes identiques. L'air qui est constitué à la fois par des molécules de dioxygène et de diazote est un mélange.
• Nous généraliserons : un corps constitué par des molécules identiques est un corps pur. Un corps constitué par deux ou plusieurs sortes de molécules est un mélange.
III. Molécules et états de la matière
1. Cas de la molécule d'eau
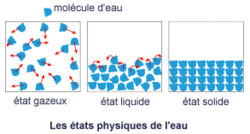 |
• Plus la température augmente et plus les molécules d'eau s'agitent.
• À basse température, elles sont pratiquement immobiles : c'est l'état solide (glace).
• À partir de 0°C, les molécules glissent les unes contre les autres mais restent groupées : c'est l'état liquide (eau liquide).
• Au-delà de 100°C, les molécules se déplacent librement dans toutes les directions : c'est l'état gazeux (vapeur d'eau).
• Lors des changements d'état, le nombre de molécules d'eau reste inchangé, en conséquence, la masse reste constante.
• On dira que la masse est conservée au cours des changements d'état.
2. Cas général
Le modèle moléculaire permet de bien comprendre les changements d'état de la matière. Chaque état physique correspond à un comportement particulier de la matière, en fonction de la température et de la pression.
• État gazeux : les molécules se déplacent librement dans tout l'espace qui leur est alloué. Elles sont dispersées et désordonnées. Elles s'entrechoquent et percutent les parois en permanence. L'ensemble de tous ces chocs constitue la pression. Si on diminue le volume dans lequel elles se déplacent, elles percutent plus souvent les parois et la pression augmente. Plus la température est élevée, plus les molécules se déplacent rapidement. Leur vitesse étant plus grande, elles percutent plus souvent les parois et la pression augmente.
On retiendra : l'état gazeux est désordonné et dispersé.
On retiendra : l'état gazeux est désordonné et dispersé.
• État liquide : les molécules se déplacent les unes par rapport aux autres. Elles sont toujours désordonnées mais se disposent de manière compacte ; cela explique que les liquides coulent, qu'ils occupent le fond du récipient qui les contient et que leur surface est plane.
On retiendra : l'état liquide est désordonné et compact.
Les molécules étant très proches les unes des autres, le volume ne peut être réduit, l'eau et l'ensemble des liquides ne sont pas compressibles au contraire des gaz.
On retiendra : l'état liquide est désordonné et compact.
Les molécules étant très proches les unes des autres, le volume ne peut être réduit, l'eau et l'ensemble des liquides ne sont pas compressibles au contraire des gaz.
• État solide : les molécules ne bougent pratiquement plus, elles se disposent de manière compacte et ordonnée (lorsque le solide est formé de cristaux).
On retiendra : l'état solide est compact et ordonné pour les solides cristallins.
On retiendra : l'état solide est compact et ordonné pour les solides cristallins.
IV. Molécules et mélanges
1. Diffusion d'un gaz dans l'air
• Disposons sur une soucoupe quelques gouttes de parfum et éloignons nous. Au bout de quelques instants, on sent l'odeur du parfum, pourquoi ? Le parfum dans la soucoupe s'évapore et ses molécules diffusent dans l'air, se déplacent et parviennent jusqu'au nez de l'expérimentateur. On observe un phénomène identique avec tous les corps volatils (c'est-à-dire qui se vaporisent facilement). Les molécules du parfum et l'air constituent un mélange gazeux.
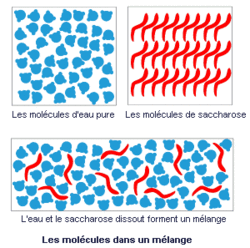
2. Dissolution d'un corps dans l'eau
• Lorsqu'on place un morceau de sucre (saccharose) dans un verre d'eau que l'on agite, le sucre semble disparaître. L'eau et le sucre sont constitués de molécules. Au cours de l'agitation, les molécules de saccharose moins nombreuses se dispersent au sein des molécules d'eau et on obtient un mélange liquide.
 |
• Remplaçons le morceau de sucre par quelques gouttes de colorant alimentaire, nous verrons la couleur se répartir dans tout le liquide. De même que dans le cas de la dissolution du sucre dans l'eau, les molécules de colorant se répartissent à travers les molécules d'eau et l'ensemble forme un mélange liquide.
• Remuons maintenant vivement l'eau contenue dans un verre avec une cuillère. Au cours de l'agitation, les molécules d'air (dioxygène et diazote) au-dessus du verre vont venir se dissoudre dans l'eau, elles se répartissent au sein des molécules d'eau et l'ensemble constitue un mélange liquide.
• Les molécules du corps dissous (soluté), solide, liquide ou gaz, se mélangent aux molécules d'eau (solvant) pour donner un mélange liquide homogène appelé solution.
• À noter : certains liquides ou solides ne peuvent pas former de solution avec l'eau, on dit qu'ils sont insolubles dans l'eau, par exemple l'huile.
© 2000-2026, Miscellane