Les corps purs et les mélanges
I. Différence entre corps pur et mélange
• Un corps pur est un matériau constitué d'une seule espèce chimique, contrairement au mélange qui en comporte plusieurs. Un corps pur simple est constitué d'un seul type d'atomes (exemples : fer, Fe ; dioxygène, O2(g) …). Un corps pur composé est constitué de plusieurs types d'atomes (exemples : sel, NaCl(s) ; sucre, C6H12O6(s) …).
• On différencie les corps purs notamment grâce à leurs températures de changement d'état (fusion, ébullition…), à leur masse volumique (qui change selon l'état physique), à leur solubilité dans différents solvants.
II. Mélange homogène, mélange hétérogène
• Il existe deux types de mélanges :
- les mélanges homogènes : on ne peut pas distinguer les constituants à l'œil nu après agitation du mélange ;
- les mélanges hétérogènes : on observe plusieurs phases après agitation.
• Un mélange homogène liquide est appelé solution chimique. Une substance solide qu'on dissout dans un solvant liquide est appelée soluté (exemple : le sucre qui se dissout dans le solvant eau).
• Pour évaluer la solubilité d'un soluté dans un solvant, on mesure la masse maximum de soluté qu'on réussit à dissoudre dans un litre de solution.
• La masse totale se conserve lorsqu'on effectue un mélange.
| Nature des espèces mélangées → Aspect du mélange  | Soluté + solvant (Solide + liquide) | Solvant + solvant (Liquide + liquide) |
| Homogène | Le soluté est soluble dans le solvant. Exemple : sel dans l'eau. | Les solvants sont miscibles. Exemple : sirop et eau. |
| Hétérogène | Le soluté n'est pas soluble dans le solvant. Exemple : craie et eau. | Les solvants ne sont pas miscibles. Exemple : huile et vinaigre. |
III. Analyse d'un mélange homogène
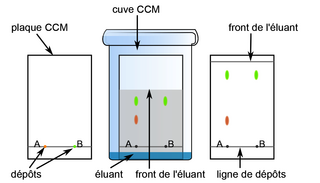
• Pour analyser les constituants d'un mélange homogène, on réalise une chromatographie sur couche mince :
- on dépose une goutte du mélange sur une plaque (papier-filtre) ;
- on place la plaque dans la cuve : l'éluant monte par capillarité, en entraînant avec lui les constituants du mélange ;
- les constituants migrent à des vitesses différentes : ils se séparent.
 |
© 2000-2026, Miscellane