Modélisation des transformations nucléaires de la matière et transfert d'énergie
Fiche
Nous sommes entourés de noyaux radioactifs et donc de radiations : le radon présent naturellement dans le sol, les rayons cosmiques, la médecine… La radioactivité de l'uranium fut mise en évidence par hasard par Henri Becquerel. Elle fut ensuite utilisée par Pierre et Marie Curie qui découvrirent le polonium et le radium. À présent, c'est grâce à la fission des noyaux d'uranium qu'une bonne partie de l'électricité est produite en France et c'est grâce à la fusion nucléaire que les étoiles comme notre Soleil brillent et nous chauffent.
I. Les isotopes
• On représente un noyau d'un atome de symbole X par deux nombres : A et Z.
- A est appelé nombre de masse : il représente le nombre de nucléons, c'est-à-dire le nombre total de protons et de neutrons.
- Z est le nombre de charge ou numéro atomique : il représente le nombre de protons.
• Comme le noyau est composé de nucléons c'est-à-dire de protons et de neutrons, pour connaître le nombre de neutrons présents dans le noyau il faut soustraire A (nombre de masse) à Z (nombre de charge) : N = A − Z.
• Un élément chimique est caractérisé par son numéro atomique Z. Tous les atomes ayant le même numéro atomique ont le même symbole. Le même numéro atomique Z entraîne le même nombre de protons contenus dans le noyau des atomes.
• On appelle isotopes, des noyaux ayant le même nombre de charge Z (même nombre de protons), mais des nombres de masse Adifférents (donc des nombres différents de neutrons).
Exemple : isotopes de l'hydrogène : 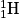 [1 proton et (1 − 1) = 0 neutron] ;
[1 proton et (1 − 1) = 0 neutron] ;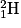 [1 proton et (2 − 1) = 1 neutron] et
[1 proton et (2 − 1) = 1 neutron] et 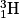 [1 proton et (3 − 1) = 2 neutrons].
[1 proton et (3 − 1) = 2 neutrons].
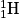 [1 proton et (1 − 1) = 0 neutron] ;
[1 proton et (1 − 1) = 0 neutron] ;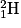 [1 proton et (2 − 1) = 1 neutron] et
[1 proton et (2 − 1) = 1 neutron] et 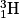 [1 proton et (3 − 1) = 2 neutrons].
[1 proton et (3 − 1) = 2 neutrons].II. Les transformations nucléaires
• Lors d'une transformation nucléaire, les noyaux des atomes sont modifiés. Mais il y a conservation du nombre de masse A (qui représente le nombre de nucléons) et il y a conservation du nombre de charge Z qui représente le nombre de protons. Il y a émission d'un rayonnement appelé rayonnement gamma et noté γ.
Donc lors d'une transformation nucléaire, un noyau père se désintègre spontanément en émettant un noyau fils, une particule et un rayonnement électromagnétique γ :
noyau père → noyau fils + particule + γ.
Exemple : les noyaux de plutonium se transforment en noyaux d'uranium et d'hélium. Il y a émission d'un rayonnement gamma.
Donc lors d'une transformation nucléaire, un noyau père se désintègre spontanément en émettant un noyau fils, une particule et un rayonnement électromagnétique γ :
noyau père → noyau fils + particule + γ.
Exemple : les noyaux de plutonium se transforment en noyaux d'uranium et d'hélium. Il y a émission d'un rayonnement gamma.
• Seuls les noyaux instables subissent spontanément (sans l'intervention de l'homme) une transformation nucléaire. Le caractère stable ou instable dépend du nombre de protons par rapport au nombre de neutrons. Un diagramme (N, Z) représentant tous les noyaux connus sur Terre (2 800 environ) permet d'identifier un noyau stable d'un noyau instable. La courbe noire qui permet d'identifier les noyaux stables et qui se dessine sur le diagramme (N, Z) ci-après est appelée la vallée de stabilité.
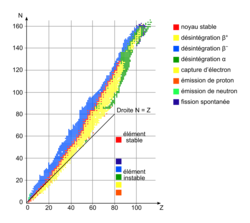 |
III. Modéliser une transformation nucléaire
• Les transformations nucléaires sont modélisées par une réaction nucléaire qui traduit la conservation du nombre de charge et du nombre de masse. Ce sont les lois de Soddy. Par contre, l'élément chimique ne se conserve pas : les noyaux des atomes sont modifiés.
• Lors d'une transformation nucléaire, il y a émission d'une particule :
- un électron
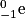 ;
; - un positon
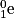 ;
; - un noyau d'hélium
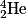 appelé parfois particule α ;
appelé parfois particule α ; - un neutron
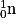 lors des réactions de fusion.
lors des réactions de fusion.
• Pour écrire une réaction nucléaire, le noyau père sera noté à gauche de la flèche, le noyau fils à droite de la flèche et les lois de conservations sont respectées.
Exemples :
Le nombre de charge Z : 92 = 90 + 2.
Le nombre de charge Z : 27 = 28 − 1.
Le nombre de charge Z : 15 = 14 + 1.
- La désintégration du noyau d'uranium (U) en thorium (Th) :
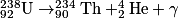 .
.
Le nombre de charge Z : 92 = 90 + 2.
- La désintégration du noyau de cobalt (Co) en nickel (Ni) :
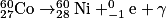 .
.
Le nombre de charge Z : 27 = 28 − 1.
- La désintégration du noyau de phosphore (P) en silicium (Si) :
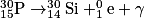 .
.
Le nombre de charge Z : 15 = 14 + 1.
IV. Transformations nucléaires dans les centrales nucléaires et dans le Soleil
• Dans le Soleil, la température extrêmement élevée qui y règne permet d'avoir les conditions pour que des transformations nucléaires s'y déroulent. Deux isotopes de l'hydrogène fusionnent pour donner un noyau d'hélium et un neutron selon la réaction suivante : 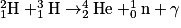 . Chaque seconde, le soleil transforme 600 millions de tonnes d'hydrogène en hélium. L'énergie mise en jeu dans cette transformation nucléaire est bien plus grande que tous les autres types de transformations.
. Chaque seconde, le soleil transforme 600 millions de tonnes d'hydrogène en hélium. L'énergie mise en jeu dans cette transformation nucléaire est bien plus grande que tous les autres types de transformations.
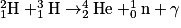 . Chaque seconde, le soleil transforme 600 millions de tonnes d'hydrogène en hélium. L'énergie mise en jeu dans cette transformation nucléaire est bien plus grande que tous les autres types de transformations.
. Chaque seconde, le soleil transforme 600 millions de tonnes d'hydrogène en hélium. L'énergie mise en jeu dans cette transformation nucléaire est bien plus grande que tous les autres types de transformations.• Les centrales nucléaires fonctionnent avec la fission nucléaire. C'est une transformation nucléaire au cours de laquelle un noyau père instable (l'uranium 235) bombardé par un neutron se transforme en deux noyaux fils plus légers (le césium et le rubidium) et des particules selon la réaction suivante : 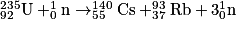 . L'énergie libérée par la fission de l'uranium est convertie en énergie électrique.
. L'énergie libérée par la fission de l'uranium est convertie en énergie électrique.
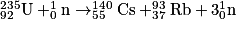 . L'énergie libérée par la fission de l'uranium est convertie en énergie électrique.
. L'énergie libérée par la fission de l'uranium est convertie en énergie électrique.• Exemples :
- La fission de 1 g de noyau d'uranium 235 libère une énergie environ égale à 80 000 000 kJ.
- La fusion de 1 g de noyau d'hydrogène libère une énergie environ égale à 400 000 000 kJ
- La combustion de 1 g de pétrole libère une énergie environ égale à 40 kJ.
V. Identification de la nature d'une transformation
• Plusieurs différences existent entre les différentes transformations physiques, chimiques ou nucléaires. Pour identifier le type de transformation, il faut regarder les réactifs et les produits.
• S'il y a conservation de l'espèce chimique alors il s'agit d'une transformation physique. Par exemple, lorsque l'eau se vaporise, l'espèce eau (H2O) se conserve. On pourra écrire : H2O(l) → H2O(g).
• Si l'espèce chimique ne se conserve pas, mais que l'élément chimique se conserve alors il s'agit d'une transformation chimique. Par exemple dans la combustion du charbon dans le dioxygène, les atomes de carbone (C) se conservent et les atomes d'oxygène (O) se conservent aussi. On pourra écrire : C(s) + O2(g) → CO2(g).
• Si l'espèce chimique ne se conserve pas ni les éléments chimiques, alors il s'agit d'une transformation nucléaire. Dans les étoiles ce sont des réactions de fusion qui ont lieu entre deux noyaux d'hydrogène et l'on obtient un noyau d'hélium. Dans les centrales nucléaires, ce sont des réactions de fission. Un noyau d'uranium est bombardé par un neutron et on obtient des noyaux plus légers (le césium et le rubidium ou le xénon et le strontium) et des neutrons.
À retenir :
Savoir définir et identifier les isotopes.
Savoir reconnaître un noyau stable et un noyau instable.
Savoir écrire symboliquement une réaction nucléaire et savoir établir à partir des noyaux père et fils, l'équation de la réaction nucléaire associée.
Relier l'énergie convertie dans le Soleil et dans une centrale nucléaire à des réactions nucléaires.
Savoir identifier la nature physique, chimique ou nucléaire d'une transformation à partir de sa description ou d'une écriture symbolique modélisant la transformation.
Savoir définir et identifier les isotopes.
Savoir reconnaître un noyau stable et un noyau instable.
Savoir écrire symboliquement une réaction nucléaire et savoir établir à partir des noyaux père et fils, l'équation de la réaction nucléaire associée.
Relier l'énergie convertie dans le Soleil et dans une centrale nucléaire à des réactions nucléaires.
Savoir identifier la nature physique, chimique ou nucléaire d'une transformation à partir de sa description ou d'une écriture symbolique modélisant la transformation.
© 2000-2026, Miscellane