Modélisation des transformations chimiques de la matière et transfert d'énergie
Fiche
On ne peut pas extraire toutes les espèces de la nature. Parfois, les procédés utilisés sont compliqués ou polluants ; parfois, les quantités nécessaires sont très importantes. Le chimiste a alors recours à la synthèse : il recopie la molécule présente dans la nature par des transformations chimiques. Il faut avoir pris le soin de bien connaître la réaction qui modélise cette transformation.
I. La transformation chimique
• On appelle transformation chimique, le passage d'un système chimique d'un état initial à un état final avec transformation des espèces chimiques.
Exemple : la corrosion du fer dans le dioxygène de l'air transforme le fer en rouille (oxyde de fer).
Exemple : la corrosion du fer dans le dioxygène de l'air transforme le fer en rouille (oxyde de fer).
• L'état initial : fer et dioxygène.
• L'état final : oxyde de fer.
• Les transformations peuvent être totales ou non. Dans l'exemple précédent, comme les transformations sont réalisées dans le dioxygène de l'air, il restera du dioxygène.
II. Modéliser une transformation chimique
• Les espèces qui sont présentes dans l'état initial sont appelées réactifs et leur quantité de matière diminue au cours de la transformation chimique.
• Les espèces qui apparaissent dans l'état final sont appelées produits et leur quantité de matière augmente au cours de la transformation chimique.
• Lorsque la quantité de matière d'une espèce n'évolue pas (ne change pas) au cours d'une transformation chimique, alors c'est une espèce spectatrice.
• On modélise la transformation chimique par une réaction chimique qui sera associée à une équation chimique (ou équation-bilan). Pour écrire une équation chimique, on place une flèche horizontale vers la droite, les réactifs sont placés à gauche de la flèche et les produits à droite de la flèche :
réactifs → produits.
La flèche symbolise la transformation chimique. On ne note pas dans les équations chimiques les espèces spectatrices.
Exemple : le butane qui est un gaz, brûle dans le dioxygène de l'air et se transforme en dioxyde de carbone et eau :
butane + dioxygène → dioxyde de carbone + eau.
réactifs → produits.
La flèche symbolise la transformation chimique. On ne note pas dans les équations chimiques les espèces spectatrices.
Exemple : le butane qui est un gaz, brûle dans le dioxygène de l'air et se transforme en dioxyde de carbone et eau :
butane + dioxygène → dioxyde de carbone + eau.
• Au cours d'une transformation chimique, les éléments chimiques (le nombre d'atomes) et la charge électrique se conservent. Pour écrire une équation chimique en écriture symbolique, il est donc nécessaire d'ajuster les nombres devant les formules chimiques. Ces nombres sont appelés nombres stœchiométriques. On dit que l'on équilibre l'équation chimique.
Exemple : le butane de formule C4H10, brûle dans le dioxygène de formule O2 et se transforme en dioxyde de carbone de formule CO2 et en eau (H2O). L'équation de la réaction est :
2C4H10 + 13O2 → 8CO2 + 10H2O.
Nombre d'atomes de carbone C : 2 × 4C → 8C.
Nombre d'atomes d'hydrogène H : 2 ×0H → 10 × 2H.
Nombre d'atomes d'oxygène O :13 ×2O → 8 × 2O + 10 × 1O.
Exemple : le butane de formule C4H10, brûle dans le dioxygène de formule O2 et se transforme en dioxyde de carbone de formule CO2 et en eau (H2O). L'équation de la réaction est :
2C4H10 + 13O2 → 8CO2 + 10H2O.
Nombre d'atomes de carbone C : 2 × 4C → 8C.
Nombre d'atomes d'hydrogène H : 2 ×0H → 10 × 2H.
Nombre d'atomes d'oxygène O :13 ×2O → 8 × 2O + 10 × 1O.
• Quelques réactions courantes et leur équation chimique équilibrée :
- La combustion du méthane (CH4) dans le dioxygène (O2) produit du dioxyde de carbone (CO2) et de l'eau (H2O) :CH4} + 2O2 → CO2 + 2H2O}.
- La corrosion du zinc de formule (Zn) par un acide de formule (H+) produit des ions zinc (Zn2+) et du dihydrogène (H2) : Zn + 2H+ → Zn2++ H2.
- L'action d'un acide de formule H+ sur le calcaire de formule CaCO3 produit des ions calcium (Ca2+ ), du dioxyde de carbone (CO2) et de l'eau (H2O) : CaCO3 + 2H+ → Ca2++CO2 + H2O.
- L'action de l'acide chlorhydrique de formule H+ + Cl− sur l'hydroxyde de sodium de formule Na+ + HO− produit de l'eau (H2O) : H++HO- → H2O. On notera que les espèces Cl− et Na+ sont des espèces spectatrices.
III. Bilan de matière et réactif limitant
• Le bilan de matière consiste à faire l'inventaire de toutes les espèces présentes à l'état final (après la transformation chimique) et à donner les quantités de matière de chacune.
• Lorsque, au cours d'une transformation chimique, un des réactifs est entièrement consommé, on l'appelle le réactif limitant. Si tous les réactifs sont entièrement consommés, on dit alors que le mélange est en proportion stœchiométrique.
• Prenons en exemple l'équation-bilan de la combustion du butane : 2C4H10 + 13O2 → 8CO2 + 10H2O.
- Pour que le mélange soit en proportion stœchiométrique il faut que
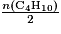 =
=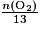 .
. - Si
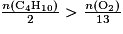 alors le dioxygène est le réactif limitant.
alors le dioxygène est le réactif limitant. - Si
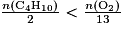 alors le butane est le réactif limitant.
alors le butane est le réactif limitant.
IV. Transformations endothermiques et exothermiques
• Les transformations chimiques nécessitant un apport d'énergie donc un transfert thermique positif (Q > 0) sont dites endothermiques (la température du milieu extérieur diminue). Les transformations chimiques cédant de l'énergie donc ayant un transfert thermique négatif (Q < 0) sont dites exothermiques (la température du milieu extérieur augmente).
V. Synthèse d'une espèce chimique présente dans la nature
• La synthèse d'une espèce chimique consiste à la fabriquer à partir d'autres espèces. On distingue les espèces chimiques naturelles qui sont issues de la nature et les espèces chimiques synthétiques qui sont fabriquées au laboratoire. Mais il n'y a aucune différence entre une espèce chimique naturelle et une espèce chimique synthétique.
• Pour réaliser une synthèse, on utilise très souvent un chauffage à reflux. Le réfrigérant à eau permet de liquéfier les gaz qui s'échappent du ballon : ils retombent alors dans le ballon. Le montage à reflux permet donc d'éviter les pertes de matière tout en maintenant le chauffage des réactifs et ainsi accélérer la transformation.
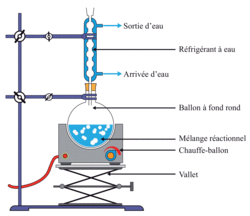 |
• Pour séparer, identifier et contrôler la pureté du produit obtenu, on utilise une chromatographie sur couche mince (CCM). L'éluant va entraîner les espèces déposées sur la ligne de base de la plaque différemment : les mélanges se séparent en corps purs. Les mêmes espèces migrent à la même hauteur.
Exemple : chromatographie sur couche mince des trois dépôts : un vert (à analyser), un bleu (substance de référence) et un jaune (substance de référence). On voit que le dépôt vert s'est séparé en bleu et en jaune. Le bleu est monté à la même hauteur que le bleu de référence et le jaune est également monté à la même hauteur que le jaune de référence. On peut alors en conclure que le dépôt vert est composé de deux corps purs, le bleu et le jaune.
Exemple : chromatographie sur couche mince des trois dépôts : un vert (à analyser), un bleu (substance de référence) et un jaune (substance de référence). On voit que le dépôt vert s'est séparé en bleu et en jaune. Le bleu est monté à la même hauteur que le bleu de référence et le jaune est également monté à la même hauteur que le jaune de référence. On peut alors en conclure que le dépôt vert est composé de deux corps purs, le bleu et le jaune.
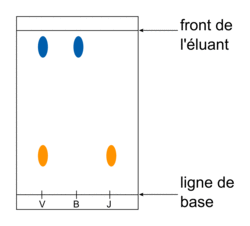 |
À retenir :
Savoir modéliser une transformation par une réaction chimique, savoir établir l'équation de réaction et savoir l'ajuster avec les nombres stoechiométriques.
Savoir établir l'écriture symbolique d'une réaction chimique.
Savoir identifier le réactif limitant à partir des quantités de matière des réactifs et de l'équation de réaction.
Connaître les différences entre transformations chimiques endothermiques et exothermiques.
Savoir modéliser la réaction de combustion du carbone et du méthane, la corrosion d'un métal par un acide, l'action d'un acide sur le calcaire, l'action de l'acide chlorhydrique sur l'hydroxyde de sodium.
Connaître les similitudes entre les espèces chimiques synthétisées dans la nature et les espèces chimiques synthétisées au laboratoire.
Savoir réaliser le schéma légendé d'un montage à reflux et d'une chromatographie sur couche mince.
Savoir modéliser une transformation par une réaction chimique, savoir établir l'équation de réaction et savoir l'ajuster avec les nombres stoechiométriques.
Savoir établir l'écriture symbolique d'une réaction chimique.
Savoir identifier le réactif limitant à partir des quantités de matière des réactifs et de l'équation de réaction.
Connaître les différences entre transformations chimiques endothermiques et exothermiques.
Savoir modéliser la réaction de combustion du carbone et du méthane, la corrosion d'un métal par un acide, l'action d'un acide sur le calcaire, l'action de l'acide chlorhydrique sur l'hydroxyde de sodium.
Connaître les similitudes entre les espèces chimiques synthétisées dans la nature et les espèces chimiques synthétisées au laboratoire.
Savoir réaliser le schéma légendé d'un montage à reflux et d'une chromatographie sur couche mince.
© 2000-2026, Miscellane