Modélisation de la matière à l'échelle microscopique
Fiche
L'atome est constitué de plusieurs particules : les nucléons et les électrons. Ce sont les électrons, surtout ceux de valence, qui permettent de prévoir la réactivité des atomes. Ainsi M. Mendeleïev avait prévu en 1869 de classer tous les atomes connus de l'époque dans un tableau : le tableau périodique des éléments. Ceux qui se retrouvent dans la même colonne de cette classification ont la même réactivité chimique.
I. L'atome
• L'atome est constitué d'un noyau et d'électrons qui tournent autour du noyau. Un atome est électriquement neutre.
Constitution du noyau
Le noyau est chargé positivement. Il est constitué de deux types de particules, les protons et les neutrons : on les appelle les nucléons.
Le noyau de l'atome de symbole X est :
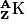 ,
,
où A est le nombre de nucléons ou nombre de masse et représente le nombre de nucléons (protons + neutrons),
et Z est le numéro atome et représente le nombre de protons.
Le numéro atomique Z caractérise un élément chimique qui sera représenté par un symbole comportant une lettre majuscule avec parfois une lettre minuscule.
Exemple :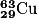 possède dans son noyau 29 protons et 63 − 29 = 34 neutrons.
possède dans son noyau 29 protons et 63 − 29 = 34 neutrons.
Le noyau de l'atome de symbole X est :
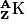 ,
,où A est le nombre de nucléons ou nombre de masse et représente le nombre de nucléons (protons + neutrons),
et Z est le numéro atome et représente le nombre de protons.
Le numéro atomique Z caractérise un élément chimique qui sera représenté par un symbole comportant une lettre majuscule avec parfois une lettre minuscule.
Exemple :
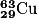 possède dans son noyau 29 protons et 63 − 29 = 34 neutrons.
possède dans son noyau 29 protons et 63 − 29 = 34 neutrons.Charge électrique de l'atome
Les protons sont chargés positivement et ont une charge : e = 1,6 × 10−19 C. La charge e est appelée charge élémentaire. Un neutron ne porte aucune charge électrique. Les électrons sont chargés négativement et ont une charge de −e = −1,6 × 10−19 C.
Comme il y a autant de protons que d'électrons dans un atome, il en résulte que l'atome est électriquement neutre.
Comme il y a autant de protons que d'électrons dans un atome, il en résulte que l'atome est électriquement neutre.
Masse et dimension de l'atome
La masse des protons et des neutrons est bien plus grande que celle des électrons. On peut donc négliger la masse des électrons devant celle des nucléons.
L'ordre de grandeur du rayon d'un atome est 10−10 m. L'ordre de grandeur du rayon du noyau d'un atome est de 10−15 m. Donc le noyau est 100 000 fois plus petit que l'atome. Entre les électrons et le noyau, il n'y a rien : c'est le vide. On dit que l'atome a une structure lacunaire.
L'ordre de grandeur du rayon d'un atome est 10−10 m. L'ordre de grandeur du rayon du noyau d'un atome est de 10−15 m. Donc le noyau est 100 000 fois plus petit que l'atome. Entre les électrons et le noyau, il n'y a rien : c'est le vide. On dit que l'atome a une structure lacunaire.
II. Le cortège électronique
• Les électrons autour du noyau sont appelés le cortège électronique. Ils se répartissent en couches (repérées par des chiffres) et en sous-couches (repérées par des lettres). Chaque sous-couche ne peut contenir qu'un nombre limité d'électrons. La sous-couche s contient au maximum 2 électrons, la sous-couche p contient au maximum 6 électrons…
• Les électrons se répartissent selon un ordre déterminé : 1s, puis 2s, puis 2p, puis 3s, puis 3p… Il faut que la sous-couche soit pleine (ou saturée) pour que les électrons passent à la sous-couche suivante.
• Les électrons de valence qui sont responsables de la réactivité chimique de l'atome sont ceux qui occupent la couche électronique de numéro le plus élevé.
• Exemple : l'atome d'oxygène Z = 8 aura une configuration électronique 1s2 2s2 2p4. Les électrons de valence sont ceux qui occupent la couche n° 2 et sont au nombre de 2 + 4 = 6.
III. Le tableau périodique
• Le tableau périodique classe les éléments chimiques par numéro atomique de façon croissante. Une couche correspond à une ligne : elle est appelée période. Une colonne comporte tous les éléments qui présentent des similitudes de propriétés et qui ont le même nombre d'électrons de valence : elle est appelée famille.
• La dernière colonne constitue la colonne des gaz nobles. Ils sont chimiquement inertes. Leur stabilité et leur inertie chimique sont dues à leur configuration électronique : ils ont leurs couches pleines, on dit aussi saturées.
• Le numéro de la couche donne donc le numéro de la période et le nombre d'électrons de valence donne le numéro de la colonne.
IV. Stabilisation des atomes par formation d'ions ou de molécules
• Pour devenir stable, l'atome va perdre ou gagner un ou plusieurs électrons afin d'acquérir la configuration électronique du gaz noble le plus proche dans le tableau périodique. L'atome formera des ions ou des molécules.
Les ions
L'ion formé découle de la position de l'atome dans le tableau périodique. Pour les trois premières colonnes, les atomes auront tendance à perdre un ou plusieurs électrons et pour les trois avant-dernières colonnes, les atomes auront tendance à gagner un ou plusieurs électrons.
Si l'atome perd un ou plusieurs électrons, il formera un ion positif appelé cation.
Exemple : l'ion hydrogène : H+, l'ion sodium : Na+, l'ion potassium : K+, l'ion calcium :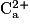 , l'ion magnésium : Mg2+.
, l'ion magnésium : Mg2+.
Si l'atome gagne un ou plusieurs électrons, il formera un ion négatif appelé anion.
Exemple : l'ion fluorure : F−, l'ion chlorure : Cl−.
Si l'atome perd un ou plusieurs électrons, il formera un ion positif appelé cation.
Exemple : l'ion hydrogène : H+, l'ion sodium : Na+, l'ion potassium : K+, l'ion calcium :
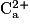 , l'ion magnésium : Mg2+.
, l'ion magnésium : Mg2+.Si l'atome gagne un ou plusieurs électrons, il formera un ion négatif appelé anion.
Exemple : l'ion fluorure : F−, l'ion chlorure : Cl−.
Électroneutralité de la matière
La matière est toujours électriquement neutre. De ce fait, un corps composé d'anions et de cations contiendra toujours un nombre de cations et d'anions dont les charges se compensent. On pourra ainsi prévoir la proportion des cations et des anions dans le corps.
Exemple : le chlorure de magnésium MgCl2 contient deux fois plus d'ions chlorure Cl−, que d'ions magnésium Mg2+ afin de respecter l'électroneutralité de la matière.
Exemple : le chlorure de magnésium MgCl2 contient deux fois plus d'ions chlorure Cl−, que d'ions magnésium Mg2+ afin de respecter l'électroneutralité de la matière.
Les molécules
Afin d'acquérir la configuration des gaz nobles, les atomes peuvent aussi former des molécules. Dans une molécule, les atomes mettent en commun un électron de valence : ils forment une liaison covalente, on dit qu'ils sont unis par un doublet liant.
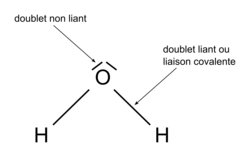
Dans le schéma de Lewis d'une molécule, tous les doublets sont représentés par des tirets. Les doublets liants modélisent les liaisons entre les atomes et les doublets non liants modélisent les paires d'électrons de valence non engagés dans des liaisons.
Dans le schéma de Lewis d'une molécule, tous les doublets sont représentés par des tirets. Les doublets liants modélisent les liaisons entre les atomes et les doublets non liants modélisent les paires d'électrons de valence non engagés dans des liaisons.
Schéma de Lewis (ou représentation de Lewis) de la molécule d'eau
 |
• L'énergie de liaison d'une liaison covalente A – B correspond à l'énergie nécessaire pour rompre la liaison et reformer les atomes isolés A et B. Plus cette énergie est grande et plus la liaison est stable.
V. Compter les entités chimiques
• La quantité de matière n d'une entité chimique, exprimée en mole, contient exactement 6,022 × 1023 entités. Ce nombre est appelé nombre d'Avogadro et se note NA = 6,022 × 1023 mol−1.
• Si N est le nombre d'entités chimiques, alors la quantité de matière n (en mol) est donnée par :
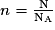 .
.
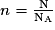 .
.• La masse d'une entité est égale à la masse des atomes qui la composent. Ainsi, pour N nombre d'entité chimique et m la masse de l'échantillon, la masse me de l'entité est : m = N × me.
À retenir :
Savoir distinguer les espèces moléculaires des espèces ioniques.
Savoir définir une espèce chimique comme une collection d'un nombre très élevé d'entités identiques.
Savoir exploiter l'électroneutralité de la matière pour associer des espèces ioniques et citer des formules de composés ioniques.
Connaître les définitions et savoir distinguer les molécules, les atomes, les ions, les anions, les cations.
Connaître l'écriture conventionnelle du noyau de l'atome. Distinguer les électrons, les protons et les neutrons et connaître les charges électriques et les masses de chacune de ces particules.
Savoir citer l'ordre de grandeur de la valeur de la taille de l'atome et savoir comparer la taille et la masse d'un atome et de son noyau.
Savoir déterminer la position de l'élément dans le tableau périodique à partir de la donnée de la configuration électronique de l'atome à l'état fondamental et inversement.
Savoir trouver la configuration électronique d'un atome à l'état fondamental et en déduire les électrons de valence.
Savoir associer la notion de famille chimique à l'existence de propriétés communes et identifier la famille des gaz nobles.
Comprendre la stabilité chimique des gaz nobles, des ions monoatomiques et des molécules.
Réaliser le schéma de Lewis et savoir l'exploiter pour justifier la stabilité des ions par rapport aux atomes isolés.
Savoir associer qualitativement l'énergie d'une liaison entre deux atomes à l'énergie nécessaire pour rompre cette liaison.
Déterminer la masse d'une entité à partir de sa formule brute et de la masse des atomes qui la composent.
Déterminer le nombre d'entité et la quantité de matière (en mol) d'une espèce dans une masse d'échantillon.
Savoir distinguer les espèces moléculaires des espèces ioniques.
Savoir définir une espèce chimique comme une collection d'un nombre très élevé d'entités identiques.
Savoir exploiter l'électroneutralité de la matière pour associer des espèces ioniques et citer des formules de composés ioniques.
Connaître les définitions et savoir distinguer les molécules, les atomes, les ions, les anions, les cations.
Connaître l'écriture conventionnelle du noyau de l'atome. Distinguer les électrons, les protons et les neutrons et connaître les charges électriques et les masses de chacune de ces particules.
Savoir citer l'ordre de grandeur de la valeur de la taille de l'atome et savoir comparer la taille et la masse d'un atome et de son noyau.
Savoir déterminer la position de l'élément dans le tableau périodique à partir de la donnée de la configuration électronique de l'atome à l'état fondamental et inversement.
Savoir trouver la configuration électronique d'un atome à l'état fondamental et en déduire les électrons de valence.
Savoir associer la notion de famille chimique à l'existence de propriétés communes et identifier la famille des gaz nobles.
Comprendre la stabilité chimique des gaz nobles, des ions monoatomiques et des molécules.
Réaliser le schéma de Lewis et savoir l'exploiter pour justifier la stabilité des ions par rapport aux atomes isolés.
Savoir associer qualitativement l'énergie d'une liaison entre deux atomes à l'énergie nécessaire pour rompre cette liaison.
Déterminer la masse d'une entité à partir de sa formule brute et de la masse des atomes qui la composent.
Déterminer le nombre d'entité et la quantité de matière (en mol) d'une espèce dans une masse d'échantillon.
© 2000-2026, Miscellane