Évolution d'un système chimique
Fiche
Nous sommes entourés de transformations chimiques : une huile qui devient rance, une statue en cuivre qui se couvre de vert-de-gris, l'utilisation de vinaigre pour détartrer la cafetière. L'étude de la composition initiale et finale du système est donc primordiale pour comprendre toutes ces transformations.
I. Quelles sont les transformations modélisées par une réaction d'oxydoréduction ?
Qu'est-ce qu'un oxydant ? Un réducteur ? Un couple d'oxydoréduction ?
• Définition :
- Un oxydant est une espèce chimique capable de capter un ou plusieurs électrons.
- Un réducteur est une espèce chimique capable de céder un ou plusieurs électrons.
- Un couple oxydant/réducteur est un ensemble constitué d'un oxydant et d'un réducteur susceptible de céder un ou plusieurs électrons. Le couple s'écrit : Ox/Red.
• Exemple : Dans le couple Fe3+/Fe2+, les ions Fe3+représentent l'oxydant et les ions Fe2+ représentent le réducteur du couple.
Exercice n°1
Exercice n°1
Qu'est-ce qu'une oxydation ? Une réduction ?
• Définition :
Une oxydation est une réaction au cours de laquelle il y a perte d'un ou plusieurs électrons. La demi-équation d'oxydation s'écrit :
Une oxydation est une réaction au cours de laquelle il y a perte d'un ou plusieurs électrons. La demi-équation d'oxydation s'écrit :
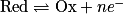 ,
,- avec Red : le réducteur, Ox : l'oxydant, n : nombre entier et e− : l'électron.
- Une réduction est une réaction au cours de laquelle il y a gain d'un ou plusieurs électrons. La demi-équation de réduction s'écrit :
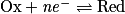 ,
,- avec Red : le réducteur, Ox : l'oxydant, n : nombre entier et e− : l'électron.
• Exemple :
- La demi-équation :
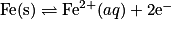 est une oxydation, car il y a perte de deux électrons.
est une oxydation, car il y a perte de deux électrons. - La demi- équation :
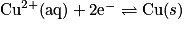 est une réduction, car il y a gain de deux électrons.
est une réduction, car il y a gain de deux électrons.
Qu'est-ce qu'une réaction d'oxydoréduction ?
• Définition : Une réaction d'oxydoréduction résulte d'un transfert d'électrons entre le réducteur d'un couple et l'oxydant d'un autre couple.
• Exemple : les ions cuivre (II) réagissent sur le fer. L'équation de la réaction est :
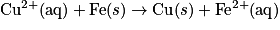 .
.
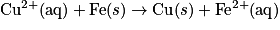 .
.• Les ions cuivre (II) sont réduits, tandis que le métal fer est oxydé. Il y a transfert de deux électrons du fer vers les ions cuivre (II). Il s'agit donc d'une réaction d'oxydoréduction.
Comment établir une équation de la réaction d'oxydoréduction ?
• On effectue la réaction entre les ions Ag+ et les atomes de Cu. Les couples mis en présence sont Ag+/Ag et Cu2+/Cu.
– Écrire les deux demi-équations d'oxydoréduction et les équilibrer :
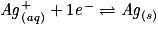
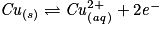 .
.
– L'équation bilan finale ne doit contenir aucun électron : multiplier les coefficients des demi-équations pour qu'il y ait autant d'électrons à gauche qu'à droite :
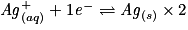
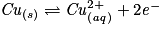 .
.
– Écrire la(ou les) demi-équation(s) modifiée(s) :
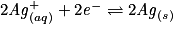
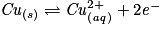 .
.
– Additionner membre à membre :
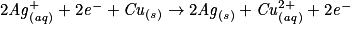 .
.
L'équation est :
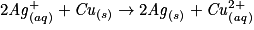 .
.
Exercice n°3
Exercice n°4
– Écrire les deux demi-équations d'oxydoréduction et les équilibrer :
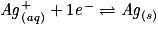
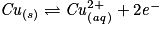 .
.– L'équation bilan finale ne doit contenir aucun électron : multiplier les coefficients des demi-équations pour qu'il y ait autant d'électrons à gauche qu'à droite :
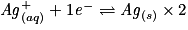
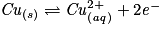 .
.– Écrire la(ou les) demi-équation(s) modifiée(s) :
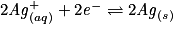
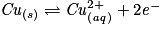 .
.– Additionner membre à membre :
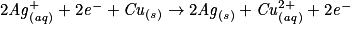 .
.L'équation est :
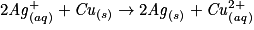 .
.Exercice n°3
Exercice n°4
II. Comment décrire l'évolution d'un système chimique ?
Qu'est-ce que l'avancement ?
Exemple d'évolution de la composition d'un système au cours d'une transformation chimique
 |
• À l'état initial : le système est constitué de dihydrogène H2(g) et de dioxygène O2(g).
• Au cours de la transformation : de l'eau H2O(l) apparaît tandis que le dihydrogène et le dioxygène disparaissent.
• À l'état final : il n'y a plus de dihydrogène et il reste du dioxygène.
• Définition :
- La quantité de matière, notée x, appelée avancement de la réaction, permet de suivre l'évolution de la composition d'un système au cours d'une transformation chimique.
- Les quantités de matière des réactifs consommés et les quantités de produits formés sont proportionnelles à une grandeur x, appelée avancement de la réaction. Elle permet de décrire l'évolution d'un système chimique. Elle s'exprime en mol.
- À l'état initial, l'avancement est nul. À l'état final, lorsque le réactif limitant est totalement consommé, l'avancement atteint sa valeur finale,
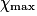 .
.
• L'avancement maximal de la transformation est atteint quand un réactif a été totalement consommé. Ce réactif est appelé le réactif limitant. Les autres réactifs sont dits en excès.
Comment décrire l'évolution d'un système chimique avec un tableau d'avancement ?
• Le tableau d'avancement décrit l'évolution des quantités de matière des réactifs et des produits de l'état initial à l'état final.
| Toutes les quantités en mol | Avancement | 2 H2 (g) | + | O2 (g) | → | 2 H2O (l) | ||
| État initial | 0,0 | 4,0 | 3,0 | 0,0 | ||||
| En cours de transformation | x | 4,0 − 2.x | 3,0 − x | 0,0 + 2.x | ||||
• L'état final est atteint quand l'un au moins des réactifs a été entièrement consommé : c'est le réactif limitant. L'avancement est alors maximal.
| Hypothèse n° 1 | H2 est le réactif limitant alors 4,0 − 2. 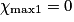 | 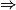 | 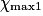 = 2,0 mol. = 2,0 mol. |
| Hypothèse n° 2 | O2 est le réactif limitant alors 3,0 − 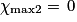 | 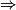 | 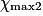 = 3,0 mol. = 3,0 mol. |
• 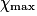 correspond à la plus faible valeur de x annulant au moins une quantité de matière des réactifs.
correspond à la plus faible valeur de x annulant au moins une quantité de matière des réactifs.
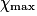 correspond à la plus faible valeur de x annulant au moins une quantité de matière des réactifs.
correspond à la plus faible valeur de x annulant au moins une quantité de matière des réactifs.• Dans l'exemple ci-dessus, on retient donc 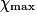 = 2,0 mol. On peut ajouter une ligne au tableau précédent :
= 2,0 mol. On peut ajouter une ligne au tableau précédent :
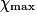 = 2,0 mol. On peut ajouter une ligne au tableau précédent :
= 2,0 mol. On peut ajouter une ligne au tableau précédent :| Toutes les quantités en mol. | Avancement | 2 H2 (g) | + | O2 (g) | → | 2 H2O (l) | ||
| État initial | 0,0 | 4,0 | 3,0 | 0,0 | ||||
| En cours de transformation | x | 4,0 − 2.x | 3,0 − x | 0,0 + 2.x | ||||
| État maximal | 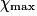 = 2,0 = 2,0 | 0,0 | 3,0 − 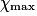 = 1,0 = 1,0 | 2.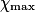 = 4,0 = 4,0 | ||||
Qu'est-ce qu'un mélange stœchiométrique ?
• Définition :
- Un mélange est dit stœchiométrique si les quantités de matière initiales des réactifs qui le constituent sont dans les proportions des nombres stœchiométriques de ces réactifs dans l'équation de la réaction.
- Dans ce cas, les quantités de matière de tous les réactifs s'annulent pour la même valeur de l'avancement. À la fin de la transformation chimique, tous les réactifs sont entièrement consommés.
• Exemple : Soit la réaction suivante : C3H8(g)
+5 O2(g) → 3 CO2 (g) + 4 H2O (l).
Le mélange initial sera stœchiométrique si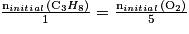 .
.
+5 O2(g) → 3 CO2 (g) + 4 H2O (l).
Le mélange initial sera stœchiométrique si
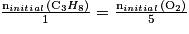 .
.Qu'est-ce qu'une réaction non totale ?
• La synthèse de l'éthanoate de benzyle C9H10O2, est une réaction d'estérification selon :
C2H4O2 + C7H8O →C9H10O2 + H2O.
C2H4O2 + C7H8O →C9H10O2 + H2O.
• Si on effectue la réaction dans les proportions stœchiométriques, à la fin il reste à la fois de l'alcool C7G8O et de l'acide C2H4O2.
• Le tableau d'avancement du système chimique précédent est le suivant :
| Toutes les quantités en mol | Avancement | C2H4O2 | + | C7H8O | → | C9H10O2 | + | H2O |
| État initial | 0,0 | 1,0 | 1,0 | 0,0 | 0,0 | |||
| En cours de transformation | x | 1,0 − x | 1,0 − x | x | x | |||
| État maximal | 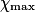 = 1,0 = 1,0 | 1,0 − 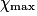 = 0,0 = 0,0 | 1,0 − 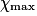 = 0,0 = 0,0 | 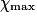 = 1,0 = 1,0 | 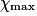 = 1,0 = 1,0 | |||
| État final réel | 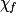 | 1,0 − 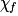 = 0,3 = 0,3 | 1,0 − 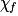 = 0,3 = 0,3 | 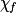 = 0,7 = 0,7 | 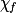 = 0,7 = 0,7 | |||
• Or, on ne récupère qu'environ 0,7 mol d'ester et il reste 0,3 mol d'acide et d'alcool. Cette observation est en désaccord avec le fait que la réaction soit totale.
• Il est donc possible de créer une molécule d'ester et une molécule d'eau lorsqu'une molécule d'alcool et une molécule d'acide entrent en collision. Mais il est possible qu'une molécule d'eau et une molécule d'ester entrent en collision. Une nouvelle molécule d'alcool et une molécule d'acide se forment alors.
• Il y a donc un équilibre qui se crée entre la réaction qui se produit dans le sens direct et celle qui se produit dans le sens indirect.
• Définition :
- Un système chimique, siège d'une réaction limitée (non totale), atteint un équilibre chimique lorsque les concentrations des différentes espèces n'évoluent plus. Cet état d'équilibre est dynamique : il ne traduit pas l'existence de deux transformations inverses se produisant simultanément. À l'échelle macroscopique, le système n'évolue plus.
- La réaction sera alors notée avec une double flèche
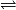 .
. - On introduit l'avancement final
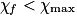 qui traduira l'état final observé du système.
qui traduira l'état final observé du système.
Que faut-il faire avec Python ?
• La transformation chimique a pour équation :
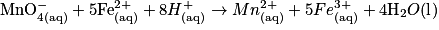 .
.
Les ions hydrogène sont en excès et l'eau est le solvant : les ions hydrogène et l'eau n'influencent pas la composition du système final. La réaction est totale.
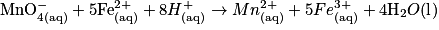 .
.Les ions hydrogène sont en excès et l'eau est le solvant : les ions hydrogène et l'eau n'influencent pas la composition du système final. La réaction est totale.
• Le tableau d'avancement est :
| Toutes les quantités en mol. | Avancement | 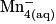 | + | 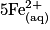 | + | 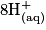 | 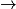 | 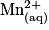 | + | 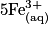 | + | 4H2O(l) |
| État initial | 0,0 | no_MnO4 | no_Fe2 | Excès | no_Mn2 = 0,0 | no_Fe3 = 0,0 | Solvant | |||||
| En cours de transformation | x | no_MnO4 − x | no_Fe2 − 5x | Excès | x | 5x | Solvant | |||||
| État maximal | 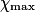 | no_MnO4 − 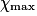 | no_Fe2 − 5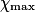 | Excès | 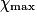 = 0,0 = 0,0 | 5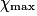 | Solvant | |||||
• Recherche du réactif limitant :
Hypothèse n°1 :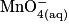 est le réactif limitant alors no_MnO4 −
est le réactif limitant alors no_MnO4 − 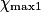 = 0
= 0 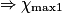 = no_MnO4
= no_MnO4
Hypothèse n°2 :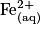 est le réactif limitant alors no_Fe2 − 5
est le réactif limitant alors no_Fe2 − 5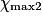 = 0
= 0 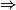
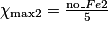 .
.
Hypothèse n°1 :
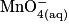 est le réactif limitant alors no_MnO4 −
est le réactif limitant alors no_MnO4 − 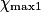 = 0
= 0 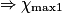 = no_MnO4
= no_MnO4Hypothèse n°2 :
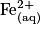 est le réactif limitant alors no_Fe2 − 5
est le réactif limitant alors no_Fe2 − 5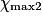 = 0
= 0 
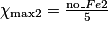 .
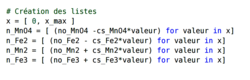
.• 1/ Enregistrer les coefficients stœchiométriques dans des variables nommées :
 |
• 2/ Demander la composition initiale de tout le système :
 |
• 3/ Chercher le réactif limitant, pour cela on calcule les deux avancements possibles et on teste celui qui donne l'avancement le plus petit :
 |
• 4/ Pour voir l'évolution du système chimique sur un graphique, il faut auparavant créer des listes pour contenir toutes les valeurs des quantités de matière du système : pour l'avancement x et pour les quantités de matière de chaque constituant :
 |
• 5/ Importer la bibliothèque graphique et créer le graphique :
 |
À savoir et à savoir réaliser :
- À partir de données expérimentales, identifier le transfert d'électrons entre deux réactifs et le modéliser par des demi-équations électroniques et par une réaction d'oxydoréduction.
- Établir une équation de la réaction entre un oxydant et un réducteur, les couples oxydant-réducteur étant donnés.
- Décrire qualitativement l'évolution des quantités de matière des espèces chimiques lors d'une transformation.
- Établir le tableau d'avancement d'une transformation chimique à partir de l'équation de la réaction et des quantités de matière initiales des espèces chimiques.
- Déterminer la composition du système dans l'état final en fonction de sa composition initiale pour une transformation considérée comme totale.
- Déterminer l'avancement final d'une réaction à partir de la description de l'état final et comparer à l'avancement maximal.
- Déterminer la composition de l'état final d'un système et l'avancement final d'une réaction.
- Capacité numérique : déterminer la composition de l'état final d'un système, siège d'une transformation chimique totale, à l'aide d'un langage de programmation.
© 2000-2026, Miscellane