Les chimistes se sont très vite confrontés à un problème d'échelle à cause de la différence entre la taille de l'atome et la nôtre. De ce fait, une nouvelle grandeur, la mole est née.
I. Quelles sont les grandeurs qui permettent de décrire un système chimique ?
Qu'est-ce que le nombre d'Avogadro ?
• Il y a deux échelles d'observation de la matière : l'échelle macroscopique dont les dimensions sont perceptibles par l'homme et l'échelle microscopique qui est l'échelle des « corpuscules » individuels. Une quantité macroscopique de matière contient un très grand nombre de corpuscules.
• On choisit un nombre appelé nombre d'Avogadro, comme référence : ce n'est pas une constante universelle. Il permet de passer d'une échelle à l'autre.
• Définition :
- Par convention, le nombre d'Avogadro
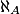 est le nombre d'atomes de carbone 12 contenu dans une masse de 12 g de carbone 12.
est le nombre d'atomes de carbone 12 contenu dans une masse de 12 g de carbone 12. - Une mole est la quantité de matière d'un système qui contient autant d'entités individuelles qu'il y a d'atomes dans 12 g de carbone 12.
- 1 mole d'entités correspond à
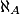 atomes, c'est-à-dire que
atomes, c'est-à-dire que 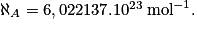
• Ainsi, si on appelle N le nombre d'entités élémentaires et n la quantité de matière en mole des entités élémentaires, on a :
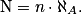
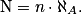
• La constante d'Avogadro fait le lien entre le monde microscopique (comportement de « N » entités élémentaires) et macroscopique (comportement de « n » mole d'entités élémentaires).
• Exemple : si n(O)2 = 0,5 mol, le nombre de molécules de dioxygène correspondant à cette quantité de matière est :
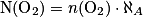
soit (O2) = 0,5 × 6,02 1023 = 3.1023 entités.
1023 = 3.1023 entités.
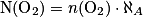
soit (O2) = 0,5 × 6,02
 1023 = 3.1023 entités.
1023 = 3.1023 entités.Qu'est-ce que la masse molaire atomique ?
• On rappelle que chaque atome est composé d'un noyau de nucléons et d'électrons. Si le numéro atomique d'un atome X est Z et son nombre de nucléons A, l'atome sera noté : 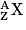 . De plus, il sera composé de :
. De plus, il sera composé de :
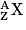 . De plus, il sera composé de :
. De plus, il sera composé de :- Z électrons ;
- Z protons ;
- A – Z neutrons.
• Comme la masse des électrons 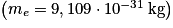 est très petite devant la masse des nucléons
est très petite devant la masse des nucléons 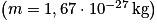 , elle sera négligeable.
, elle sera négligeable.
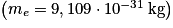 est très petite devant la masse des nucléons
est très petite devant la masse des nucléons 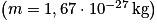 , elle sera négligeable.
, elle sera négligeable.• Définition :
- La masse molaire atomique d'une entité chimique est la masse d'une mole d'atomes de cette entité.
- C'est une caractéristique d'un élément chimique.
• Ainsi, si on appelle mparticule, la masse des particules qui constituent cette entité, alors la masse molaire M est donnée par la formule :
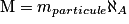 .
.
où M est en gramme par mole (g / mol ou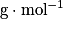 ), mparticule est en gramme, et
), mparticule est en gramme, et 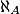 est la constante d'Avogadro.
est la constante d'Avogadro.
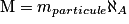 .
.où M est en gramme par mole (g / mol ou
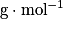 ), mparticule est en gramme, et
), mparticule est en gramme, et 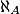 est la constante d'Avogadro.
est la constante d'Avogadro.• Exemple : Choisissons l'atome d'oxygène : 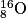 . Le noyau est constitué de 16 nucléons. La masse de ces nucléons est donc
. Le noyau est constitué de 16 nucléons. La masse de ces nucléons est donc 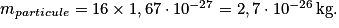
La masse molaire de l'oxygène sera donnée par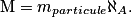
Soit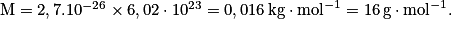
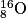 . Le noyau est constitué de 16 nucléons. La masse de ces nucléons est donc
. Le noyau est constitué de 16 nucléons. La masse de ces nucléons est donc 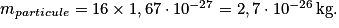
La masse molaire de l'oxygène sera donnée par
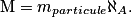
Soit
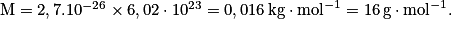
• Pour connaître la masse molaire d'une entité chimique atomique, il suffit de consulter le tableau périodique qui donnera les masses molaires atomiques d'un élément chimique dans un échantillon naturel qui est généralement constitué d'un mélange d'isotopes.
• Exemples :
- la masse molaire atomique de l'hydrogène est de 1,0 g/mol. Elle sera notée :
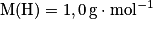 . Cela signifie qu'une mole d'hydrogène (
. Cela signifie qu'une mole d'hydrogène (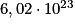 atomes) pèse 1,0 g.
atomes) pèse 1,0 g. - la masse molaire atomique du carbone est 12 g.mol−1. Elle sera notée :
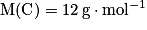 . Cela signifie qu'une mole de carbone (
. Cela signifie qu'une mole de carbone (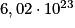 atomes) pèse 12,0 g.
atomes) pèse 12,0 g.
Comment déterminer la quantité de matière à partir de la masse molaire atomique ?
• Définition : la quantité de matière d'un élément chimique est le rapport entre la masse de cet élément et la masse molaire atomique :
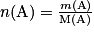 ,
,
où n(A) est la quantité de matière de l'élément A en moles,
m(A) est la masse de l'élément A en grammes,
M(A) est la masse molaire de l'élément A en grammes par mole.
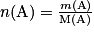 ,
,où n(A) est la quantité de matière de l'élément A en moles,
m(A) est la masse de l'élément A en grammes,
M(A) est la masse molaire de l'élément A en grammes par mole.
• Exemple : la quantité de matière contenue dans 20,0 g d'argon, sachant que la masse molaire atomique de l'argon vaut : 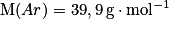 , est :
, est :
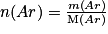 ,
,
soit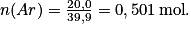 Exercice n°1
Exercice n°1
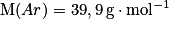 , est :
, est :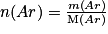 ,
,soit
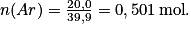 Exercice n°1
Exercice n°1Qu'est-ce que la masse molaire moléculaire ?
• Définition : la masse molaire moléculaire M(A) d'une espèce chimique moléculaire A représente la masse d'une mole de ses molécules. Elle est égale à la somme des masses molaires atomiques des atomes présents dans la molécule.
• Exemples :
La masse molaire moléculaire de l'eau H2O :
M (H2O) = 2 M (H) + 1 M (O) = 18 g.mol−1.
La masse molaire moléculaire de l'espèce chimique de formule brute C8H8O6 :
M(C8H8O6) = 8.M (C) + 8 M (H) + 6 M (O) = 200 g.mol−1.
La masse molaire moléculaire de l'eau H2O :
M (H2O) = 2 M (H) + 1 M (O) = 18 g.mol−1.
La masse molaire moléculaire de l'espèce chimique de formule brute C8H8O6 :
M(C8H8O6) = 8.M (C) + 8 M (H) + 6 M (O) = 200 g.mol−1.
Qu'est-ce que le volume molaire d'un gaz ?
• On note que lorsque les conditions de température et de pression sont les mêmes, une mole de gaz occupe le même volume, quel que soit le gaz considéré.
• Définition : on appelle volume molaire d'une espèce chimique le volume occupé par une mole de cette espèce. On le note Vm (unité : L/mol ou L . mol−1).
• Le volume molaire dépend de la pression et de la température. Ainsi à pression atmosphérique :
- 0°C : Vm = 22,4 L
 mol−1
mol−1 - 20°C : Vm = 24 L
 mol−1
mol−1
Comment déterminer la quantité de matière d'un gaz ?
• Définition : la quantité de matière d'un gaz occupant le volume V est le rapport entre le volume de ce gaz et le volume molaire de ce gaz à pression et température données :
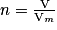
où n est la quantité de matière du gaz considéré en mole,
V est le volume du gaz en litre,
Vm est le volume molaire du gaz à pression et température donnée en L.mol−1.
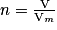
où n est la quantité de matière du gaz considéré en mole,
V est le volume du gaz en litre,
Vm est le volume molaire du gaz à pression et température donnée en L.mol−1.
• Exemple : La quantité de matière d'un volume V de 10,0 L d'un gaz, sachant que le volume molaire est Vm = 24 L  mol−1 est donnée par :
mol−1 est donnée par : 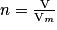 ,
,
soit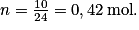
 mol−1 est donnée par :
mol−1 est donnée par : 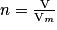 ,
,soit
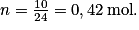
Comment déterminer la quantité de matière à partir d'un pourcentage massique ?
• Définition : le pourcentage massique d'une substance dans un composé solide est le quotient de la masse de ce constituant par la masse totale du composé solide multiplié par cent :
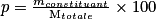
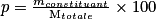
• Exemple : Un alliage de bronze de 250 g contient 70,0 % en masse de cuivre et 30,0 % en masse d'étain. Pour déterminer la quantité de matière, il faut auparavant avoir déterminé la masse de chaque constituant.
Données :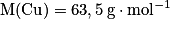 et
et 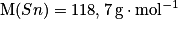 .
.
Masse de cuivre :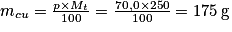 .
.
Masse d'étain :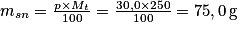 .
.
Quantité de matière de cuivre :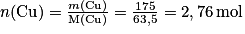 .
.
Quantité de matière d'étain :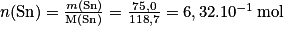 .
.
Données :
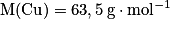 et
et 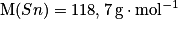 .
.Masse de cuivre :
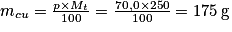 .
.Masse d'étain :
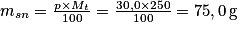 .
.Quantité de matière de cuivre :
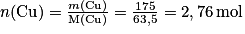 .
.Quantité de matière d'étain :
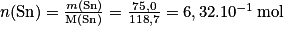 .
.Comment déterminer la quantité de matière à partir d'une masse volumique ?
• On rappelle que la masse volumique 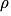 d'une substance est définie comme le quotient de la masse m de la substance par le volume V qu'elle occupe :
d'une substance est définie comme le quotient de la masse m de la substance par le volume V qu'elle occupe :
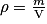
où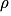 est en
est en 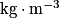
V le volume en m3
m en kg.
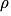 d'une substance est définie comme le quotient de la masse m de la substance par le volume V qu'elle occupe :
d'une substance est définie comme le quotient de la masse m de la substance par le volume V qu'elle occupe :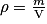
où
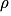 est en
est en 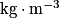
V le volume en m3
m en kg.
• La masse volumique se note parfois avec la lettre μ.
• De même, on peut définir la densité d'un liquide comme le quotient de la masse volumique de ce liquide par la masse volumique de l'eau. C'est une grandeur sans unité.
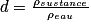 .
.
La densité de l'eau est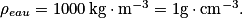
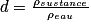 .
.La densité de l'eau est
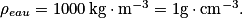
• Exemple : Cherchons la quantité de matière contenue dans un échantillon de fer de volume 50 cm3.
M(Fe) = 56,0 g.mol et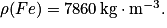
On trouve la masse connaissant la masse volumique avec la relation :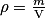 ,
,
soit m(Fe) = ρ(Fe) × V(Fe)
Or la quantité de matière est donnée par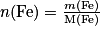 .
.
En combinant les deux relations précédentes :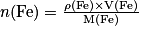
Or le volume du fer est donné en cm3, il faut le convertir. On a V = 50 cm3 = 50.10−3 dm3 = 50.16−6 m3.
De plus, la masse est en g : il faut également la convertir :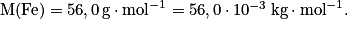
D'où numériquement :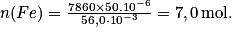
M(Fe) = 56,0 g.mol et
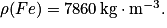
On trouve la masse connaissant la masse volumique avec la relation :
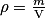 ,
,soit m(Fe) = ρ(Fe) × V(Fe)
Or la quantité de matière est donnée par
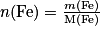 .
.En combinant les deux relations précédentes :
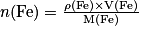
Or le volume du fer est donné en cm3, il faut le convertir. On a V = 50 cm3 = 50.10−3 dm3 = 50.16−6 m3.
De plus, la masse est en g : il faut également la convertir :
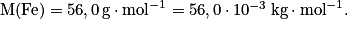
D'où numériquement :
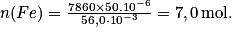
• Le pourcentage massique peut également s'appliquer dans les solutions.
• Exemple : Calculons la quantité de matière de HCl contenue dans 25,00 mL d'une solution aqueuse de HCl dont la masse volumique est de 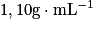 et dont le pourcentage massique en HCl est de 20,39 %. On donne M(HCl) = 36,6 g.mol−1.
et dont le pourcentage massique en HCl est de 20,39 %. On donne M(HCl) = 36,6 g.mol−1.
Le pourcentage massique en HCl est donné par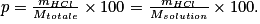
D'où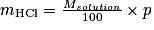
Comme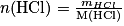
En combinant les deux relations on trouve :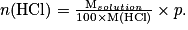
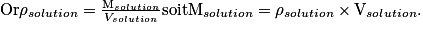
D'où en remplaçant dans la relation précédente :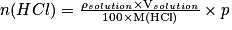 ,
,
soit
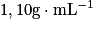 et dont le pourcentage massique en HCl est de 20,39 %. On donne M(HCl) = 36,6 g.mol−1.
et dont le pourcentage massique en HCl est de 20,39 %. On donne M(HCl) = 36,6 g.mol−1.Le pourcentage massique en HCl est donné par
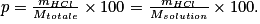
D'où
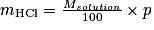
Comme
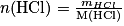
En combinant les deux relations on trouve :
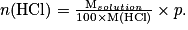
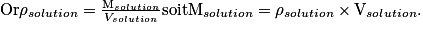
D'où en remplaçant dans la relation précédente :
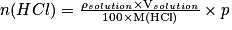 ,
,soit

Comment déterminer la quantité de matière à partir d'une concentration molaire ?
• Définition : La concentration molaire d'une espèce chimique en solution est la quantité de matière de cette espèce présente dans un litre de solution.
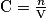 ,
,
où C est la concentration molaire de l'espèce en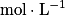 ;
;
n est la quantité de matière de l'espèce en mole ;
V est le volume de la solution en litre.
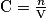 ,
,où C est la concentration molaire de l'espèce en
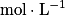 ;
;n est la quantité de matière de l'espèce en mole ;
V est le volume de la solution en litre.
• Pour les ions, on notera C ou [X] la concentration molaire des ions X en solution.
• Exemple : On sait que la solution d'ion chlorure de formule Cl− a une concentration [Cl−] = 0,1 mol.L−1. Déterminons la quantité de matière contenue dans 200 mL de cette solution :
On a![\left [ Cl^{-} \right ]= \frac{n}{v}](https://static1.assistancescolaire.com/1/images/1_ph_01_m60.png) , d'où n = [Cl−] × V,
, d'où n = [Cl−] × V,
d'où numériquement n = 0,1 × 200.10−3 = 2.10−2 mol.
On a
![\left [ Cl^{-} \right ]= \frac{n}{v}](https://static1.assistancescolaire.com/1/images/1_ph_01_m60.png) , d'où n = [Cl−] × V,
, d'où n = [Cl−] × V,d'où numériquement n = 0,1 × 200.10−3 = 2.10−2 mol.
Comment déterminer la quantité de matière à partir d'une concentration massique ?
• On rappelle que la concentration massique d'une espèce chimique en solution est la masse de cette espèce présente dans un litre de solution.
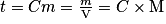
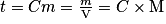
Où Cm ou t est la concentration molaire de l'espèce en 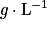 . On l'appelle aussi teneur.
. On l'appelle aussi teneur.
m est la masse de l'espèce en gramme.
V est le volume de la solution en litre.
C est la concentration molaire de l'espèce en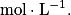
M est la masse molaire de l'espèce en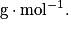
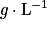 . On l'appelle aussi teneur.
. On l'appelle aussi teneur.m est la masse de l'espèce en gramme.
V est le volume de la solution en litre.
C est la concentration molaire de l'espèce en
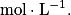
M est la masse molaire de l'espèce en
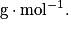
• Exemple : On sait que la solution de glucose a une concentration massique t = 18,0 L−1. Déterminons la quantité de matière contenue dans 200 mL de cette solution. On donne la masse molaire de glucose 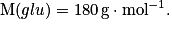
On a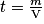 d'où m = t × V.
d'où m = t × V.
Or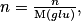
en combinant les deux relations on a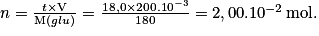
Exercice n°2Exercice n°3
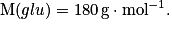
On a
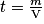 d'où m = t × V.
d'où m = t × V.Or
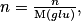
en combinant les deux relations on a
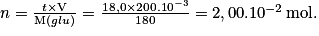
Exercice n°2Exercice n°3
II. Comment déterminer la concentration d'une espèce colorée en solution ?
Qu'est-ce que l'absorbance ?
• La couleur d'une solution résulte de la superposition des radiations non absorbées de la lumière blanche.
• L'absorbance A d'une solution est une grandeur sans unité : elle caractérise l'aptitude des espèces présentes dans la solution à absorber une radiation lumineuse de longueur d'onde donnée.
• C'est une grandeur additive : l'absorbance d'une solution est la somme des absorbances de toutes les espèces qu'elle contient.
Qu'est-ce que le spectre d'absorption ?
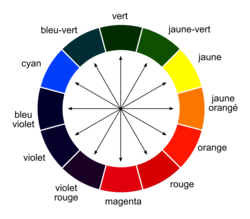
• Le spectre d'absorption correspond au tracé de l'absorbance A en fonction de la longueur d'onde.
• Une espèce incolore n'absorbe aucune radiation du spectre visible, elle n'absorbe que dans l'ultraviolet. Lorsqu'une espèce chimique n'absorbe que dans un seul domaine de longueurs d'onde du visible, sa couleur est la couleur complémentaire de celle des radiations absorbées.
 |
Quelle relation existe-t-il entre la concentration et l'absorbance ?
• La loi de Beer-Lambert : pour une longueur d'onde donnée, l'absorbance A d'une espèce en solution est proportionnelle à sa concentration c.
A = k.c, avec A sans unité.
k = ε.l avec ε coefficient d'extinction molaire (il dépend de la nature de l'espèce, de la longueur d'onde de la radiation utilisée, du solvant et de la température) et l est la largeur de la cuve.
c est la concentration de la solution étudiée (la relation précédente est vérifiée si la concentration molaire « c » est suffisamment faible (en pratique c < 10−2 mol.L−1).
A = k.c, avec A sans unité.
k = ε.l avec ε coefficient d'extinction molaire (il dépend de la nature de l'espèce, de la longueur d'onde de la radiation utilisée, du solvant et de la température) et l est la largeur de la cuve.
c est la concentration de la solution étudiée (la relation précédente est vérifiée si la concentration molaire « c » est suffisamment faible (en pratique c < 10−2 mol.L−1).
Comment déterminer la centration inconnue d'une espèce colorée ?
• On réalise un dosage. Un dosage est une méthode de détermination de la concentration d'une espèce en solution. Un dosage spectrophotométrique consiste à mesurer les absorbances de solutions colorées de concentrations connues, à une longueur d'onde donnée.
• La courbe obtenue A = f(c) permettra de déterminer la concentration inconnue à partir de la valeur de son absorbance.
Exercice n°4Exercice n°5
Exercice n°4Exercice n°5
À savoir et à savoir réaliser :
- Déterminer la masse molaire d'une espèce à partir des masses molaires atomiques des éléments qui la composent.
- Déterminer la quantité de matière contenue dans un échantillon de corps pur à partir de sa masse et du tableau périodique.
- Utiliser le volume molaire d'un gaz pour déterminer une quantité de matière.
- Déterminer la quantité de matière de chaque espèce dans un mélange (liquide ou solide) à partir de sa composition.
- Déterminer la quantité de matière d'un soluté à partir de sa concentration en masse ou en quantité de matière et du volume de solution.
- Expliquer ou prévoir la couleur d'une espèce en solution à partir de son spectre UV-visible.
- Déterminer la concentration d'un soluté à partir de données expérimentales relatives à l'absorbance de solutions de concentrations connues.
Exercice n°1
Déterminer la quantité de matière contenue dans 10 g de néon, sachant que la masse molaire atomique du néon : 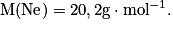
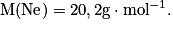
Cochez la bonne réponse.
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
|
La formule à utiliser est 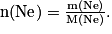 L'unité de la quantité de matière est la mole.
L'unité de la quantité de matière est la mole.
Soit numériquement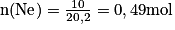 . Il faut être vigilant au nombre de chiffres significatifs. La masse est donnée avec 2 chiffres significatifs, le résultat est donc donné avec 2 chiffres significatifs.
. Il faut être vigilant au nombre de chiffres significatifs. La masse est donnée avec 2 chiffres significatifs, le résultat est donc donné avec 2 chiffres significatifs.
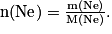 L'unité de la quantité de matière est la mole.
L'unité de la quantité de matière est la mole.Soit numériquement
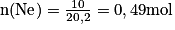 . Il faut être vigilant au nombre de chiffres significatifs. La masse est donnée avec 2 chiffres significatifs, le résultat est donc donné avec 2 chiffres significatifs.
. Il faut être vigilant au nombre de chiffres significatifs. La masse est donnée avec 2 chiffres significatifs, le résultat est donc donné avec 2 chiffres significatifs.Exercice n°2
Calculer la masse molaire du sulfate de cuivre pentahydraté de formule CuSO4, 5H2O. Avec 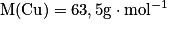 ,
, 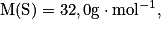
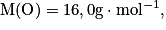
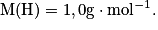
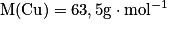 ,
, 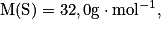
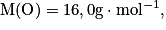
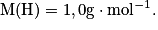
Cochez la bonne réponse.
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
|
La masse molaire est donnée par : M(CuSO4, 5H2O = M(Cu) + M(S) + 4M(O) + 5(2M(H) + M(O)). Son unité est le g.mol−1.
Soit numériquement M(CuSO4, 5H2O) = 63,5 + 32,0 + 4 × 16,0 + 5(2 × 1,0 + 16,0) = 249,5 g.mol−1.
Soit numériquement M(CuSO4, 5H2O) = 63,5 + 32,0 + 4 × 16,0 + 5(2 × 1,0 + 16,0) = 249,5 g.mol−1.
Exercice n°3
Quelle quantité de matière y a-t-il dans 120 L de propane ?
Donnée : Vm = 24,0 L.mol−1.
Donnée : Vm = 24,0 L.mol−1.
Cochez la bonne réponse.
| ||
| ||
| ||
| ||
| ||
|
La quantité de matière pour un gaz est donnée par 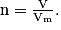
Soit numériquement :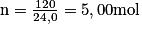 . Il faut être vigilant au nombre de chiffres significatifs. Toutes les données de l'exercice contiennent 3 chiffres significatifs, le résultat est donc donné avec 3 chiffres significatifs.
. Il faut être vigilant au nombre de chiffres significatifs. Toutes les données de l'exercice contiennent 3 chiffres significatifs, le résultat est donc donné avec 3 chiffres significatifs.
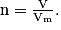
Soit numériquement :
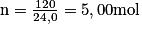 . Il faut être vigilant au nombre de chiffres significatifs. Toutes les données de l'exercice contiennent 3 chiffres significatifs, le résultat est donc donné avec 3 chiffres significatifs.
. Il faut être vigilant au nombre de chiffres significatifs. Toutes les données de l'exercice contiennent 3 chiffres significatifs, le résultat est donc donné avec 3 chiffres significatifs.Exercice n°4
Quelle quantité de matière d'acide sulfurique de formule H2SO4 est contenue dans 100 mL d'une solution à 95 % en masse d'acide sulfurique ?
Données : densité de la solution : d = 1,85 ; masse volumique de l'eau :
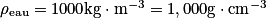 ; masse molaire d'acide sulfurique : M(H2SO4) = 98,0 g.mol−1.
; masse molaire d'acide sulfurique : M(H2SO4) = 98,0 g.mol−1.
Données : densité de la solution : d = 1,85 ; masse volumique de l'eau :
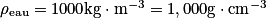 ; masse molaire d'acide sulfurique : M(H2SO4) = 98,0 g.mol−1.
; masse molaire d'acide sulfurique : M(H2SO4) = 98,0 g.mol−1. Cochez la bonne réponse.
| ||
| ||
| ||
| ||
| ||
|
Le pourcentage massique en H2SO4 est donné par 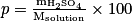
d'où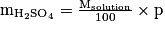 .
.
Comme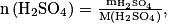
en combinant les deux relations, on trouve :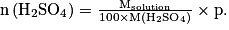
Or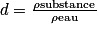 donc ρsolution = d × ρeau
donc ρsolution = d × ρeau
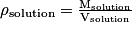 soit Msolution = ρsolution × Vsolution
soit Msolution = ρsolution × Vsolution
En combinant les deux relations : Msolution = d × ρeau × Vsolution
d'où en remplaçant dans la relation précédente :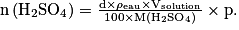
Or,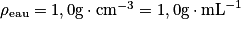
soit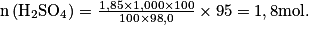
Il faut être vigilant au nombre de chiffres significatifs. Les données de l'exercice contiennent 2, 3 ou 4 chiffres significatifs, le résultat est donc donné avec 2 chiffres significatifs.
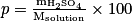
d'où
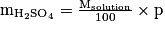 .
.Comme
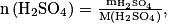
en combinant les deux relations, on trouve :
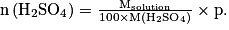
Or
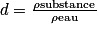 donc ρsolution = d × ρeau
donc ρsolution = d × ρeau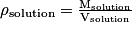 soit Msolution = ρsolution × Vsolution
soit Msolution = ρsolution × VsolutionEn combinant les deux relations : Msolution = d × ρeau × Vsolution
d'où en remplaçant dans la relation précédente :
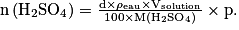
Or,
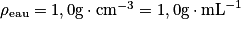
soit
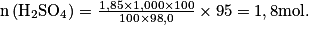
Il faut être vigilant au nombre de chiffres significatifs. Les données de l'exercice contiennent 2, 3 ou 4 chiffres significatifs, le résultat est donc donné avec 2 chiffres significatifs.
Exercice n°5
Calculer la quantité de matière de 250 mL d'une solution d'ion fer II de concentration [Fe2+] = 0,60 mol.L−1.
Cochez la bonne réponse.
| ||
| ||
| ||
|
La concentration est donnée par ![\left [ \textrm{Fe}^{2+} \right ]= \frac{\textrm{n}}{\textrm{V}},](https://static1.assistancescolaire.com/1/images/1_ph_01_m88.png) d'où n = [Fe2+] × V.
d'où n = [Fe2+] × V.
D'où, numériquement, n = 0,60 × 250.10−3 = 0,15 mol. Il faut être vigilant au nombre de chiffres significatifs. Toutes les données de l'exercice contiennent 2 ou 3 chiffres significatifs, le résultat est donc donné avec 2 chiffres significatifs.
![\left [ \textrm{Fe}^{2+} \right ]= \frac{\textrm{n}}{\textrm{V}},](https://static1.assistancescolaire.com/1/images/1_ph_01_m88.png) d'où n = [Fe2+] × V.
d'où n = [Fe2+] × V.D'où, numériquement, n = 0,60 × 250.10−3 = 0,15 mol. Il faut être vigilant au nombre de chiffres significatifs. Toutes les données de l'exercice contiennent 2 ou 3 chiffres significatifs, le résultat est donc donné avec 2 chiffres significatifs.

